ul. Bobrzyńskiego 14
30-348 Kraków
Główny telefon: +48 12 664 42 00
Główny email: cittru@uj.edu.pl
Strona www: www.cittru.uj.edu.pl
Wyślij zapytanie ofertowe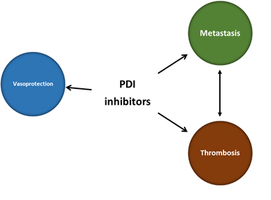
Hipoteza naukowa
Rodzina disulfidoizomeraz białek (PDI) to grupa enzymów regulujących fałdowanie białek retikulum endoplazmatycznego, przy czym PDIA1 i PDIA3 reprezentują główne izoformy.
Oprócz dobrze znanej roli PDI jako molekularnych białek opiekuńczych, dodatkowo ich aktywność wymiany dwusiarczkowej na powierzchni komórki kontroluje układ krzepnięcia, adhezję komórek rakowych (przerzuty nowotworowe) i reguluje funkcję naczyń. Tak więc białkowa izomeraza dwusiarczkowa wydaje się być interesującym celem terapeutycznym, który można wykorzystać do uzyskania działania przeciwzakrzepowego, przeciwprzerzutowego i wazoprotekcyjnego. Zgodnie z naszą najlepszą wiedzą nie ma żadnego zatwierdzonego inhibitora PDI, chociaż obecnie w fazie badań klinicznych jest sprawdzany inhibitor PDI pochodzenia naturalnego, w leczeniu zakrzepicy związanej z rakiem.
Obszar terapeutyczny
Tłumienie wewnątrzkomórkowego PDI hamuje aktywację płytek krwi i tworzenie się skrzepliny. Hamowanie zewnątrzkomórkowego PDI reguluje adhezję i migrację komórek rakowych. Wreszcie, hamowanie PDI ma działanie naczynioprotekcyjne. Co więcej, istnieją dowody sugerujące, że hamowanie PDI wykazuje działanie przeciwwirusowe.
Związki wiodące
Związki C-3389 i C-3399, odpowiednio selektywny inhibitor PDIA1 i nieselektywny inhibitor PDIA1/PDIA3, zostały wybrane z biblioteki 82 racjonalnie zaprojektowanych i przetestowanych pochodnych. Te związki lub ich kongenery wykazują niezwykłe działanie farmakologiczne w testach in vitro i in vivo. Co ważne, oba te związki nie są toksyczne w teście ostrej toksyczności in vivo.
Scientific hypothesis
Protein disulphide isomerase (PDI) family is a group of enzymes regulating endoplasmic reticulum protein folding with PDIA1 and PDIA3 representing the major isoforms.
In addition to well-known role of PDI as molecular chaperones, their cell-surface disulfide exchange activity controls thrombosis, cancer cell adhesion, metastasis and vascular function. Thus, protein disulphide isomerase seems to be an interesting therapeutic target to be exploited to afford anti-thrombotic, anti-metastatic and vasoprotective action. To the best of our knowledge there is no specific PDI inhibitor that has been approved, though flavonoid-based PDI-inhibition is currently in clinical trial to treat cancer associated thrombosis.
Therapeutic area
Suppression of intracellular PDI inhibits platelet activation and thrombus formation. Inhibition of extracellular PDI regulates cancer cell invasion and migration. Finally, inhibition of PDI has vasoprotective effects. Moreover, there is an evidence suggesting that inhibition of PDI display an anti-viral effects.
Lead Compounds
Compounds C-3389 and C-3399, the selective PDIA1 inhibitor and non-selective PDIA1/PDIA3 inhibitor, have been chosen from the library of 82 rationally designed and tested derivatives. These compounds or their congeners display a remarkable pharmacological activities in in vitro and in vivo assays. Importantly, both of these compounds are not toxic in acute toxicity assay in vivo.