Wśród mężczyzn najczęstszym nowotworem jest rak gruczołu krokowego, a wśród kobiet – rak piersi. Również nowotwory jelita grubego występują często u obu płci. Choroba onkologiczna, będąca jednym z najpoważniejszych problemów zdrowotnych na świecie, generuje ogromne napięcia zarówno dla jednostki, jak i społeczeństwa. Dla pacjenta, diagnoza raka niesie za sobą strach i niepewność, a dla lekarza – wyzwanie zaprojektowania najbardziej skutecznego planu leczenia. W ciągu ostatnich dziesięcioleci naukowcy na całym świecie przeprowadzili szereg badań mających na celu lepsze zrozumienie nowotworów, rozwijanie skuteczniejszych metod diagnostycznych i ulepszanie terapii. Przez ten czas zauważalny był gwałtowny postęp w dziedzinie onkologii, jednak mimo to potrzeba ciągle nowych rozwiązań. Jednym z najbardziej obiecujących jest płynna biopsja.
Czym jest płynna biopsja?
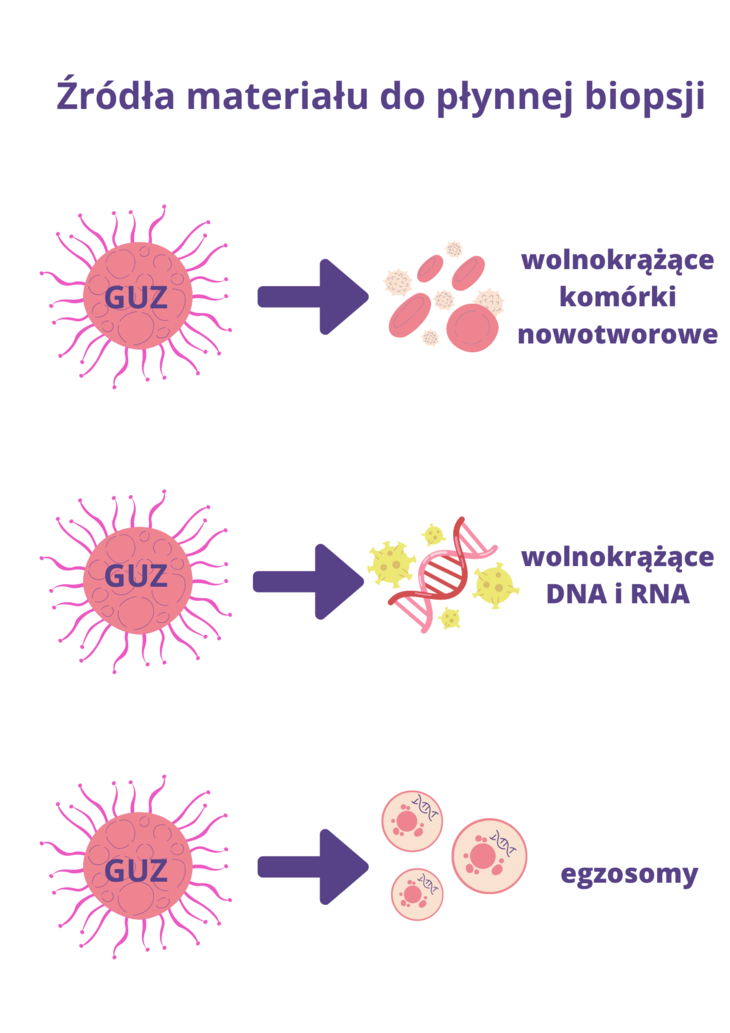
Płynna biopsja w onkologii jest odpowiednikiem klasycznej biopsji, z tą różnicą, że materiał genetyczny do analizy pobierany jest z krwi pacjenta, a nie bezpośrednio z guza. To nowatorska metoda detekcji biomarkerów nowotworowych, które można odnaleźć bezpośrednio w płynach biologicznych (np. krwi obwodowej). Materiał do badań może pochodzić z kilku źródeł. Są nimi:
1) wolnokrążące komórki nowotworowe (circulating tumor cells – CTCs). Są to komórki nowotworowe, które oderwały się od guza i trafiły do krwiobiegu pacjenta, wykrywane w różnych typach nowotworów, zasadniczo w późniejszych etapach rozwoju procesu nowotworowego, w nowotworach złośliwych. Mają mniejsze zastosowanie we wczesnej diagnostyce, większe – jako marker predykcyjny i przy doborze leków celowanych;
2) wolnokrążące DNA (circulating free DNA – cfDNA) – analiza tego rodzaju materiału jest możliwa, ponieważ wszystkie komórki, w tym komórki raka, kiedy giną, uwalniają do krwiobiegu materiał genetyczny z komórek nowotworowych podlegających procesom apoptozy i nekrozy (śmierci komórkowej). Są to małe fragmenty DNA, zwane wolnym, wolnokrążącym lub wolnocyrkulującym DNA (cell-free circulating tumor DNA – ctDNA). Co więcej, stężenie wolnokrążącego DNA nowotworowego we krwi chorego wzrasta wraz ze wzrostem nowotworu. Sugeruje to, że prosty pomiar poziomu ctDNA we krwi pacjenta może zostać wykorzystany do określania stopnia zaawansowania choroby nowotworowej oraz monitorowania skuteczności terapii. Analiza wolnokrążącego DNA, wyizolowanego z osocza krwi, może także umożliwić wykrycie i scharakteryzowanie choroby nowotworowej na bardzo wczesnym etapie, zanim możliwe byłoby jej wykrycie innymi metodami diagnostycznymi. Ponadto może on służyć jako marker predykcyjny oraz źródło tzw. płynnej biopsji do oceny stopnia zaawansowania procesów neoplastycznych i monitorowania przebiegu leczenia;
3) wolnokrążący RNA (cfRNA) – uwalniany do krwiobiegu, podobnie jak DNA w procesie nekrozy i apoptozy komórek nowotworowych. Od kilkunasty lat szczególne zainteresowanie wzbudza frakcja wolnokrążącego mikro-RNA (cfmiRNA) – krótkich cząsteczek (ok. 22-nukleotydowe), które mogą być specyficzne dla różnych typów nowotworów;
4) egzosomy – to małe, okrągłe pęcherzyki, zawierające m.in. białka, RNA, DNA, miRNA i metabolity, uwalniane przez komórki nowotworowe i wykrywane w krwi obwodowej pacjenta.
Przewagi płynnej biopsji nad biopsją tradycyjną (chirurgiczną):
* nieinwazyjność – prostota pobrania próbki (tj. probki krwi żylnej). Pacjent nie musi przechodzić przez stres i dyskomfort związane z tradycyjnymi procedurami biopsji. Może być również przeprowadzana wielokrotnie, co pozwala na monitorowanie postępów choroby w czasie rzeczywistym i dostosowywanie planu leczenia w zależności od odpowiedzi pacjenta;
* tradycyjna biopsja jest niemożliwa w przypadku licznych przerzutów do różnych organów;
* możliwość wykrycia nowotworu na bardzo wczesnym etapie (1. faza rozwoju w przypadku większości nowotworów);
* nieiwazyjność płynnej biopsji umożliwia jej wielokrotne wykonywanie w trakcie leczenia (monitorowanie terapii);
* płynna biopsja jest w stanie uchwycić heterogeniczność guza w znacznie większym stopniu niż tradycyjna biopsja tkankowa. Oznacza to, że może dostarczyć więcej informacji na temat różnych mutacji genetycznych, które mogą występować w różnych częściach tego samego guza;
* materiał z biopsji tradycyjnej (chirurgicznej) jest najczęściej uszkodzony wskutek utrwalania przy użyciu formaliny i zabezpieczania w parafinie. Materiał z płynnej biopsji jest dobrej jakości i pozwala na analizę metodą NGS.
Spersonalizowana medycyna
Spersonalizowana medycyna, znana również jako medycyna precyzyjna, to paradygmat, który stawia na czele indywidualność pacjenta. Zakłada on, że terapie powinny być dostosowywane do specyficznych cech pacjenta, w tym jego profilu genetycznego. W tym kontekście płynna biopsja może przynieść ogromne korzyści. Warunkiem zastosowania najskuteczniejszego dostępnego leczenia jest wykonanie profilowania molekularnego nowotworu. Może być przeprowadzone zarówno tradycyjną, jak i płynną biopsją. Dostępne są bazy danych gromadzące informacje o patogennych wariantach genów, powiązanych z procesami nowotworzenia, np. SANGER Institute COSMIC – Katalog Mutacji Somatycznych w Nowotworach (z ang. Catalogue of Somatic Mutations In Cancer). Poznając profil genetyczny nowotworu, można optymalnie dopasować leczenie na podstawie znanych leków do indywidualnych potrzeb pacjenta. Podstawowe bazy danych to:
* COSMIC,
* CIVIC,
Metody diagnostyki molekularnej
Zaawansowane metody diagnostyki molekularnej otworzyły drzwi dla leczenia personalizowanego w raku piersi, umożliwiając zidentyfikowanie zmian genetycznych w różnych ścieżkach sygnałowych. Pozwoliło to na stworzenie molekularnej klasyfikacji raka piersi, z takimi typami, jak: luminalny A, luminalny B, HER-dodatni, potrójnie ujemny TNBC, basal-like oraz TNBC z niską ekspresją klaudyny. Niemniej personalizowane leczenie raka sutka wciąż polega na ocenie dobrze znanych i szczegółowo opisanych markerach immunohistochemicznych, takich jak receptory estrogenowe i progesteronowe oraz amplifikacja HER2. Przykładowo obecność receptorów estrogenowych to kryterium kwalifikacji pacjentek do leczenia hormonalnego z użyciem leków, takich jak tamoxifen, raloxifen, letrozol, anastrozol. Z kolei ok. 20% pacjentek z rakiem piersi ma amplifikację HER2, co sugeruje reakcję na leki celowane na blokowanie nadekspresji HER2, takie jak trastuzumab (lub herceptyna), lapatinib i pertuzumab.
W leczeniu raka jelita grubego przeciwciała monoklonalne skierowane przeciwko receptorowi dla epidermalnego czynnika wzrostu (EGFR), takie jak panitumumab czy cetuximab, mogą być stosowane w leczeniu przerzutów. Natomiast w terapii pacjentów z czerniakiem z obecnością mutacji aktywującej V600E genu BRAF lekami z wyboru są inhibitory BRAF, takie jak vemurafenib i dabrafenib. Jeżeli chodzi o podścieliskowe nowotwory żołądka (GIST), zarówno w przypadkach z mutacją aktywującą protoonkogeny KIT lub PD-GFRA w komórkach guza, jak i w sytuacjach, gdy te mutacje nie występują, stosowanie inhibitora kinazy tyrozynowej – imitinibu – jest standardem terapeutycznym. Nowotwór płuca również korzysta z metod leczenia personalizowanego. Dzięki odkryciu obecności mutacji aktywujących w genach kodujących kinazy tyrozynowe – EGFR oraz genie ALK – możliwe stało się zahamowanie wiodącej, molekularnej ścieżki w rozwoju niedrobnokomórkowego raka płuca. Dla pacjentów z niedrobnokomórkowym rakiem płuca z mutacją aktywującą domenę kinazy tyrozynowej geny BRAF stosuje się gefitinib oraz erlotynib.
Poniżej przykłady profilowania molekularnego i skutecznego leku celowanego:
Nowotwór piersi – leki celowane molekularnie:
|
Gen |
Wariant |
Nazwa substancji czynnej (leku) |
Dodatkowe informacje |
Występuje w europejskim standardzie leczenia (wg ESMO)? |
|
PIK3CA |
H1047R |
Lapatynib |
Lapatynib jest inhibitorem wewnątrzkomórkowych domen kinazy tyrozynowej dwóch receptorów komórek nowotworowych: czynnika wzrostu naskórka (EGFR, ErbB-1) oraz ludzkiego czynnika wzrostu naskórka HER2/neu (ErbB-2). |
TAK |
|
E545K |
||||
|
ERBB2 |
L755S |
Zahamowanie aktywności tych kinaz przez lapatynib prowadzi do zahamowania podziałów komórkowych i apoptotycznej śmierci komórki nowotworowej. |
||
|
R678Q |
||||
|
D769H |
||||
|
L755P |
||||
|
T798M |
||||
|
L638S |
||||
|
V773L |
||||
|
K753E |
||||
|
PIK3CA |
H1047R |
Ewerolimus |
Ewerolimus jest inhibitorem sygnału proliferacji. Poprzez zahamowanie aktywności kinazy mTOR ogranicza podziały komórek nowotworowych oraz obniża poziom białek HIF i VEGF w nowotworze lub jego środowisku, zahamowując rozwój unaczynienia guza. |
TAK |
|
STK11 |
F354L |
|||
|
ESR1 |
Y537S |
Palbociclib |
Palbociclib jest wysoce selektywnym, odwracalnym inhibitorem kinaz zależnych od cyklin (CDK) 4 i 6, które regulują wzrost i podział komórek. Lek ten, podawany wraz z inhibitorami aromatazy lub fulwestrantem, stosowany w hormonoterapii przeciwnowotworowej, zmniejsza zdolność komórek nowotworowych do namnażania. |
TAK |
|
Y537N |
||||
|
Y537C |
||||
|
S463P |
||||
|
E380Q |
||||
|
L536R |
||||
|
PIK3CA |
H1047R |
Kadcyla (trastuzumab emtanzyny) |
Lek ten zbudowany jest z dwóch połączonych ze sobą składników czynnych: rekombinowanego, humanizowanego przeciwciała monoklonalnego IgG1, łączącego się specyficznie z domeną IV pozakomórkowej części receptora HER2 oraz DM1 – substancji toksycznej, zabijającej komórki w czasie ich podziałów i wzrostu. Preparat jest stosowany do leczenia raka sutka z przerzutami, przy którym stwierdzono nadekspresję HER2. W kombinacji z innymi chemioterapeutykami istotnie zmniejsza ryzyko nawrotu choroby i zwiększa stopień odpowiedzi na leczenie. |
TAK |
|
E545K |
||||
|
C420R |
||||
|
K111N |
||||
|
I391M |
||||
|
ERBB2 |
V777L |
|||
|
ERBB2 |
L755S |
Neratynib |
Neratynib jest inhibitorem kinazy tyrozynowej, który blokuje enzymy odpowiedzialne za wzrost komórek. Neratynib przyłącza się do białka HER na komórkach nowotworowych i blokuje ich działanie, powstrzymując wzrost komórek i zapobiegając nawrotowi nowotworu. |
TAK |
|
P780INS |
||||
|
V842I |
||||
|
V777L |
||||
|
G309A |
||||
|
R678Q |
||||
|
R896C |
||||
|
L755W |
||||
|
D769H |
||||
|
D769Y |
||||
|
L869R |
||||
|
T798I |
Nowotwór jelita grubego – leki celowane molekularnie:
|
Gen |
Wariant |
Nazwa substancji czynnej (leku) |
Dodatkowe informacje |
Występuje w europejskim standardzie leczenia (wg ESMO)? |
|
|
|
BRAF |
V600E |
Regorafenib |
Regorafenib jest inhibitorem kinazy białkowej. Blokuje działanie kinaz tyrozynowych VEGFR2-TIE2, które odgrywają istotną rolę w rozwoju układu naczyń krwionośnych, zaopatrujących guzy nowotworowe oraz we wzroście i rozwoju komórek nowotworowych. Hamując dopływ krwi do guza, zapobiega zwrostowi i rozwojowi komórek nowotworowych. |
TAK |
|
|
|
KRAS |
G13D |
|
||||
|
G12V |
|
|||||
|
G12D |
|
|||||
|
G12C |
|
|||||
|
G12A |
|
|||||
|
G12R |
|
|||||
|
G12S |
|
|||||
|
PIK3CA |
E542K |
|
||||
|
FBXW7 |
R505C |
|
||||
|
R505H |
|
|||||
|
G579W |
|
|||||
|
R658Q |
|
|||||
|
KRAS |
brak mutacji w kodonach 12, 51, 59, 117 i 146 |
Cetuksymab |
Cetuksymab jest chimerycznym przeciwciałem monoklonalnym IgG1, skierowanym swoiście przeciwko receptorowi nabłonkowego czynnika wzrostu (EGFR). Blokuje wiązanie endogennych ligandów EGFR, powodując zahamowanie czynności receptora. Szlaki przekazywania sygnałów EGFR związane są z kontrolą przeżycia komórek, progresją cyklu komórkowego, angiogenezą, migracją komórek i przerzutowaniem komórek. |
TAK |
|
|
|
NRAS |
brak mutacji w kodonach 12, 13, 59, 61 i 117 |
|||||
|
BRAF |
brak mutacji V600E |
|||||
|
BRAF |
brak mutacji V600E |
Panitumumab |
Panitumumab jest rekombinowanym, ludzkim przeciwciałem monoklonalnym IgG2, wykazującym duże powinowactwo i specyficzność wobec ludzkiego receptora EGFR, znajdującego się na powierzchni niektórych komórek i blokującym jego działanie. W wyniku tego procesu komórki nowotworu przestają otrzymywać sygnały przekazywane przez EGFR, niezbędne do namnażania się i rozprzestrzeniania się nowotworu do innych części ciała. Panitumumab powoduje zahamowania wzrostu komórek nowotworowych, indukcję apoptozy oraz zmniejszoną produkcję interleukiny 8 i czynnika wzrostu śródbłonka naczyniowego. |
TAK |
||
|
KRAS |
brak mutacji w kodonach 12, 13, 59, 51, 117 i 146 |
|||||
|
NRAS |
brak wariantu kodonach 12, 13, 59, 61 i 117 |
|||||
Podsumowanie
Onkologia personalizowana przynosi nowe nadzieje dla pacjentów z nowotworami. W ciągu ostatnich lat, naukowcy zgromadzili ogromną ilość wiedzy na temat funkcjonowania komórek nowotworowych. Zrozumieli, że komórki nowotworowe, z różnych powodów, utraciły swoją naturalną równowagę metaboliczną, co prowadzi do ich niekontrolowanego rozmnażania. Stąd powstała koncepcja terapii celowanej molekularnie, która stara się przywrócić równowagę w komórkach nowotworowych. W ostatnich latach pojawiły się nowe leki celowane uzależnione od poznania wariantu genetycznego nowotworu. Terapia celowana molekularnie polega na wykorzystaniu leków, które celują w specyficzne mechanizmy komórkowe, które są nieprawidłowe w komórkach nowotworowych. Te leki są projektowane tak, aby działać tylko na komórki nowotworowe, minimalizując wpływ na zdrowe komórki. Wiele z nich działa poprzez blokowanie specyficznych receptorów na powierzchni komórek nowotworowych, które są odpowiedzialne za nieprawidłowe funkcje komórkowe.
Terapia celowana molekularnie jest obiecującą strategią leczenia nowotworów. Ważne jest jednak, aby pamiętać, że każdy nowotwór i każdy pacjent jest inny. Leczenie musi być dostosowane do konkretnego pacjenta, a to wymaga dokładnej oceny genetycznej i profilowania molekularnego. Płynna biopsja, dzięki swoim innowacyjnym technikom sekwencjonowania i możliwościom oferowanym przez medycynę spersonalizowaną, wyznacza nowe standardy w diagnostyce i terapii nowotworów. Jest to podejście nowe i wciąż rozwijające się, ale obfituje w obiecujące możliwości. Płynna biopsja może przynieść wiele korzyści – od zmniejszenia ryzyka związanego z inwazyjnymi procedurami, poprzez poprawę efektywności terapii, aż po polepszenie jakości życia pacjentów.























KOMENTARZE