Wyzwania związane z całym procesem badań naukowych nadal jednak istnieją, szczególnie w rozwoju linii komórek iPSC. Kwestie, takie jak zapewnienie stabilności genetycznej, utrzymanie pluripotencji, optymalizacja protokołów różnicowania i skalowanie produkcji przy jednoczesnym przestrzeganiu rygorystycznych standardów kontroli jakości, nadal stanowią duże wyzwanie dla badaczy. Pomocne mogą okazać się nowoczesne technologie związane z biologią molekularną, o których mowa w dalszej części artykułu.
iPSC – możliwości i wyzwania
Uniwersalność, a zarazem elastyczność stanowią siłę badań naukowych, a wśród modeli komórkowych indukowane pluripotentne komórki macierzyste (iPSC) są wiodącą siłą. Ich niezwykła zdolność do różnicowania się w dowolny typ komórek i samoodnawiania się w nieskończoność czynią z nich narzędzie niezbędne w pracy nad lekami, medycynie regeneracyjnej i modelowaniu chorób. Typowa ścieżka badań i rozwoju iPSC zaczyna się od pozyskiwania komórek somatycznych i przeprogramowania ich do stanu pluripotentnego. Następnie naukowcy wybierają i gromadzą najbardziej obiecujące klony, które są hodowane w celu zwiększenia ich liczby przy użyciu precyzyjnej mieszanki czynników wzrostu i cytokin. Rygorystyczne testy charakteryzacji i kontroli jakości jako narzędzia selekcji decydują, które iPSC są zachowywane do dalszych etapów badań. Wyzwanie związane z hodowlami iPSC to przede wszystkim ciągły monitoring w celu kontroli zachowania prawidłowych cech podstawowych komórek.
Problem zmienności w hodowli iPSC
Jakość komórek iPSC nie jest stała. Wpływa na nią wiele czynników, w tym: źródło komórek somatycznych, metoda przeprogramowania i warunki hodowli. Etap przeprogramowania komórek jest wykonywany w momencie, gdy protokół nie jest jeszcze zoptymalizowany, co wiąże się z niższą wydajnością iPSC z początkowej populacji komórek somatycznych. Wybór składników mediów, takich jak czynniki wzrostu i cytokiny, również wpływa na rozwój i funkcjonalność iPSC oraz ich późniejsze różnicowanie w określone typy komórek do celów terapeutycznych. Regularne badania żywotności, morfologii, pluripotencji i spójnej ekspresji markerów to jedyny sposób, aby mieć pewność co do prawidłowego rozwoju najlepszych linii iPSC.
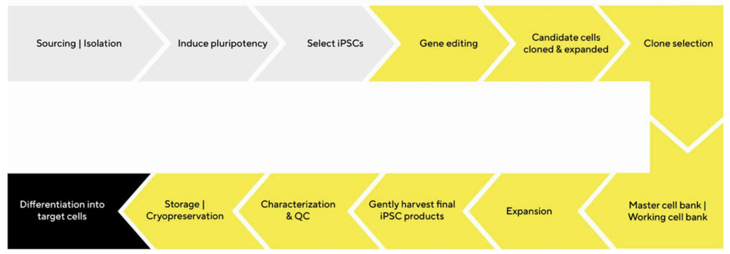
Tradycyjna charakterystyka komórek – „wąskie gardło”
Kolejne kroki w przemysłowym procesie pracy muszą być usprawnione w celu generowania danych przy najniższym koszcie na próbkę. Wyzwanie stanowi tu przełożenie dużych zestawów danych na dalsze najbardziej kluczowe decyzje. Bez odpowiednich narzędzi dużo cennego czasu poświęca się, oczekując na krytyczne dane. W rozwoju hodowli komórek iPSC jeden z głównych obszarów braku efektywności to charakterystyka komórek. Cytometria przepływowa jest podstawową techniką służącą do analizy fenotypowej i funkcjonalnej. Kluczowym ograniczeniem tradycyjnych cytometrów przepływowych jest przepustowość. Przeprowadzenie doświadczenia wymaga zapewnienia znacznej ilości próbki oraz pochłania wiele godzin pracy. Ogólnie mówiąc, każdy aspekt pracy na cytometrze może być skomplikowany – od konfiguracji doświadczenia, po analizę danych, która zazwyczaj obejmuje eksport danych pomiędzy różnymi typami oprogramowania. Wiąże się to ze znacznymi kosztami dla laboratorium oraz czasochłonnymi analizami, co z kolei przekłada się na długi czas oczekiwania na wynik. Jakie jest więc rozwiązanie? Czy są inne możliwości?
Ścieżka do niezawodnego procesu pracy z iPSC
Nowoczesne technologie zmieniają badania i rozwój iPSC, wprowadzając automatyzację i usprawnione protokoły do przygotowywania próbek, analizy danych i dokumentacji wyników. Doskonałym przykładem jest platforma cytometrii przepływowej iQue® – solidne narzędzie do badań przesiewowych o wysokiej przepustowości. Dodatkowo jest wyposażone w oprogramowanie, które zaspokaja kluczowe potrzeby zgodności analiz i umożliwia szybkie otrzymanie wyników w celu dalszego podejmowania decyzji. Ta zmiana metodologiczna poprawia skalowalność i przepustowość aplikacji iPSC do odkrywania nowych leków, ich opracowywania i selekcji oraz modelowania chorób. Ponadto dostosowane składy pożywek, obecnie bogatsze w wysokiej jakości czynniki wzrostu i cytokiny, zwiększają szanse powodzenia hodowli iPSC.
Połączone podejście maksymalizuje efektywność
W jaki sposób firmy osiągają większą wydajność? Poprzez integrację zaawansowanych technologii w jeden kompletny proces rozwoju iPSC. Na przykład połączenie analizy cytometrii przepływowej z obrazowaniem żywych komórek umożliwia kompleksowe, nieinwazyjne monitorowanie przeżywalności i morfologii komórek macierzystych. W tym kontekście platformy cytometrii przepływowej iQue® i analizy żywych komórek Incucyte® stanowią „dream team” w zakresie analizy komórek, uzupełniając się wzajemnie w celu zautomatyzowania kluczowych etapów rozwoju linii komórkowych. Obie technologie zapewniają wyjątkowe korzyści przepustowości, oszczędzając cenne próbki i zasoby naukowe (workload), a jednocześnie dostarczają kompletnych zestawów danych, umożliwiając praktyczne spostrzeżenia na temat przeżywalności komórek, ich morfologii i pluripotencji. Niezakłócająca natura analizy żywych komórek jest szczególnie przydatna do utrzymania biologii wrażliwych typów komórek, takich jak komórki macierzyste.
Zapoznaj się z materiałami pod tym linkiem, aby dowiedzieć się więcej na temat sposobów usprawniających prace badawczo-rozwojowe w zakresie iPSC.
Autorki: PhD Tina Shahian, Content Writer, Sartorius
PhD Aleksandra Wyciszkiewicz, Field Application Specialist CEE, Octet & Incucyte, Sartorius BioAnalytics
PhD Renata Gronczewska, Sales Manager BioAnalytics EEMA I mail: Renata.Gronczewska@Sartorius.com I tel.: +48 609 500 695
























KOMENTARZE