Otrzymane iPSCs charakteryzują się zdolnością do różnicowania w każdy rodzaj komórek budujących ludzki organizm, co czyni je niezwykle użytecznym narzędziem w badaniach nad wieloma chorobami. Potencjalnie komórki iPS mogą być także zastosowane do odtworzenia uszkodzonych tkanek i organów, co otwiera nowe możliwości w medycynie regeneracyjnej, np. w odniesieniu do chorób degeneracyjnych, urazów oraz zaburzeń genetycznych [2].
W Klinice Pediatrii, Onkologii i Hematologii Uniwersytetu Medycznego w Łodzi prowadzone są badania nad neutropenią wrodzoną wykorzystujące indukowane pluripotencjalne komórki macierzyste. Proces ten rozpoczyna się od pozyskania komórek somatycznych od pacjentów. Następnie, za pomocą wektorów genetycznych, wprowadzane są do tych komórek sekwencje określonych czynników transkrypcyjnych, co prowadzi do ich przekształcenia w komórki pluripotencjalne, zdolne do różnicowania się do komórek wszystkich trzech listków zarodkowych.
Po identyfikacji u pacjenta mutacji genetycznej odpowiedzialnej za neutropenię wrodzoną tworzony jest model choroby z wykorzystaniem komórek iPS w celu zgłębienia jej patogenezy oraz poszukiwania nowych opcji terapeutycznych. W ramach projektu realizowanego w Klinice przeprowadzana jest precyzyjna korekcja mutacji w komórkach iPS za pomocą narzędzi inżynierii genetycznej, w szczególności technologii CRISPR/Cas9.
W przypadku modelu komórkowego neutropenii wrodzonej, gdzie obserwowane są zahamowanie dojrzewania neutrofili oraz ich dysfunkcja, wyjściowe oraz naprawione komórki iPS różnicowane są w kierunku granulocytów. Jest to niezbędne, aby ocenić, czy korekcja mutacji sprawczej doprowadzi do przywrócenia dojrzewania i funkcjonalności tych komórek. Dzięki takiemu podejściu możliwe jest porównanie zdolności do wykrywania i eliminacji patogenów (np. poprzez fagocytozę) pomiędzy granulocytami obojętnochłonnymi pacjentów z neutropenią wrodzoną przed i po zastosowaniu metod inżynierii genomowej, a także pomiędzy komórkami kontrolnymi pozyskanymi od zdrowych osób.
W Klinice Pediatrii, Onkologii i Hematologii aktualnie prowadzone są badania nad wrodzonymi niedoborami odporności, które są chorobami rzadkimi o nie do końca zrozumianej patofizjologii. Dzięki zastosowaniu technologii komórek iPS możliwe było wytworzenie komórek macierzystych od ponad dwudziestu pacjentów. W ramach niedawno zakończonego projektu FixNet („Wyleczymy Neutropenię: wykorzystanie identyfikacji zaburzeń funkcji proteaz granulocytów obojętnochłonnych jako nowych możliwości diagnostycznych i terapeutycznych”, nr umowy POIR.04.04.00-0 0-1603/18 realizowanego w ramach Programu Operacyjnego Inteligentny Rozwój 2014-2020, Działania 4.4 [program TEAM-NET]) uzyskano linie komórek iPS od pacjentów z wrodzoną neutropenią (m.in. z mutacjami w genach ELANE, CLPB, TCIRG1, LYST, SRP54, SLC37A4, VPS13B), zaburzeniami naprawy DNA (zespołem Nijmegen oraz zespołem ataksja-teleangiektazja), hemofilią, a także zdrowych osób [3]. Otrzymane komórki iPS charakteryzowały się wielokierunkowym potencjałem różnicowania, dając początek komórkom wywodzącym się z endodermy, ektodermy oraz mezodermy (Rycina 1).
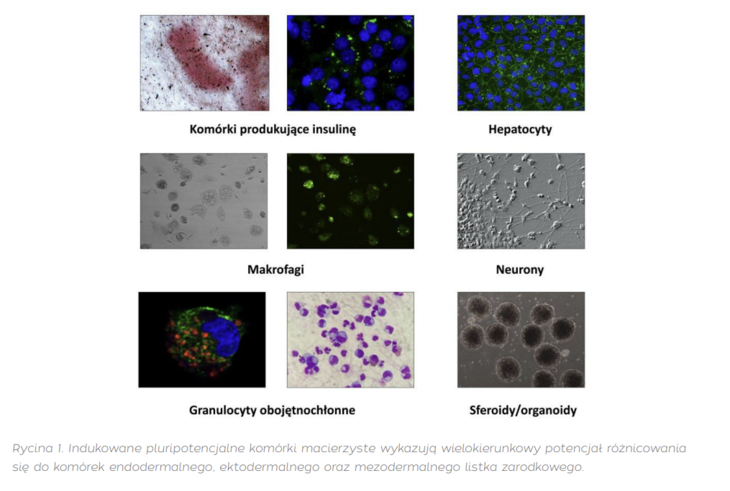
Unikalność technologii komórek iPS pozwala na modelowanie chorób genetycznych w warunkach laboratoryjnych, co umożliwia pełniejsze zrozumienie mechanizmów chorób i testowanie nowych rozwiązań terapeutycznych. Poprzez edycję za pomocą systemu CRISPR/Cas9 możliwe jest korygowanie defektów na poziomie DNA, co otwiera pole w aplikacjach wykorzystujących terapie genowe [4]. W kontekście aplikacyjnym personalizowanej medycyny warto podkreślić, że komórki iPS mogą zostać wytworzone z komórek somatycznych jakiejkolwiek osoby, zatem umożliwia to dostosowanie działań terapeutycznych opartych na takich komórkach do cech oraz indywidualnych potrzeb każdego pacjenta. Badania kliniczne nad komórkami iPS znajdują się wciąż we wczesnych etapach, ale perspektywy ich zastosowania w medycynie regeneracyjnej są bardzo obiecujące. Obecnie na całym świecie prowadzonych jest 146 prób klinicznych wykorzystujących indukowane pluripotencjalne komórki macierzyste [5]. Wraz z postępem naukowo-technologicznym można się spodziewać coraz większej liczby takich badań, które mogą zrewolucjonizować podejście do leczenia wielu chorób.
Modele komórkowe oparte na indukowanych pluripotencjalnych komórkach macierzystych mogą być także użyteczne do testowania skuteczności i bezpieczeństwa leków [6]. Dzięki temu możliwe będzie przyspieszenie procesu badań klinicznych, zmniejszenie ich kosztów oraz ewentualnego ryzyka dla pacjentów.
Autorzy:
Mgr Zuzanna Rydzyńska, doktorantka w Klinice Pediatrii, Onkologii i Hematologii, I Katedry Pediatrii Uniwersytetu Medycznego w Łodzi
Prof. dr hab. med. Wojciech Młynarski, kierownik Kliniki Pediatrii, Onkologii i Hematologii, I Katedry Pediatrii Uniwersytetu Medycznego w Łodzi
Dr n. biol. Dawid Grzela, główny specjalista ds. inżynierii komórkowej w Klinice Pediatrii, Onkologii i Hematologii, I Katedry Pediatrii Uniwersytetu Medycznego w Łodzi






















KOMENTARZE