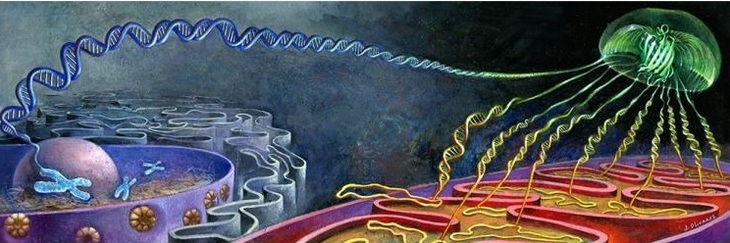
Metaforyczna ilustracja pokazująca, jak powstaje świecenie w metodzie Bi-Genomic Mitochondrial-Split-GFP. Jest do tego potrzebny fragment świecącego białka meduzy GFP1-10, który produkowany jest w mitochondriach drożdży, a także fragment GFP11 wytwarzany wraz z badanym białkiem w cytoplazmie. Jeśli takie białko dotrze do mitochondriów, dwa fragmenty znacznika GFP samoorganizują się, aby utworzyć świecące białko GFP. Ilustracja to obraz, który namalował francuski malarz Jaime Olivares.
Mitochondria, których zadaniem jest m.in. wytwarzanie komórkowej energii (w formie ATP), to organelle pochodzenia bakteryjnego. Mają własne DNA, które koduje kilka/kilkanaście białek. Ogromna większość białek potrzebnych im do działania (1000-1500, zależnie od organizmu), jest zaś kodowana przez DNA w jądrze komórki i powstaje w cytoplazmie. Dopiero stamtąd trafia zaś do mitochondriów.
W lokalizowaniu białek w komórce pomaga biologom i chemikom fluorescencja. Za pomocą inżynierii genetycznej do interesującego naukowców białka dołącza się białko fluorescencyjne. Znacznik ten sprawia, że pod mikroskopem widać sygnał fluorescencji w miejscu, gdzie znajduje się interesujące badaczy białko. Jednym z takich markerów jest wykorzystywane przez meduzy świecące na zielono białko GFP (Green Fluorescent Protein). –Jeśli jednak jakieś obserwowane przez nas białko zlokalizowane jest w cytoplazmie, pod mikroskopem cała komórka świeci na zielono. Trudno wówczas dostrzec, czy takie białko może być też obecne w innych organellach, np. w mitochondriach, bo światło z cytoplazmy przyćmiewa sygnał z mitochondriów – mówi w rozmowie z PAP dr hab. Róża Kucharczyk z Instytutu Biochemii i Biofizyki PAN.
Liczne badania wykazały zaś, że ok. 30 proc. białek mitochondrialnych znajduje się zarówno w mitochondriach, jak i w innym przedziale komórki – np. cytoplazmie czy jądrze (mówimy wówczas o podwójnie zlokalizowanych białkach). A ponieważ nie było dotąd jednoznacznej i dającej pewny wynik metody, by wyodrębnić od siebie pule danego białka w różnych częściach komórki, to nadal jest wiele niewiadomych na temat tego, jakie funkcje te białka pełnią.
Opracowany przez naukowców szczep drożdży S. cerevisiae o zmodyfikowanym genomie mitochondrialnym pozwoli na to, by obserwować sygnał fluorescencji wyłącznie mitochondrialnej frakcji białek. Sygnał ten powstanie bowiem dopiero wtedy, kiedy obserwowane białka już trafią do wnętrza mitochondrium. Wyniki badań polsko-francusko-szwajcarskiego zespołu zostały opublikowane w prestiżowym czasopiśmie „eLife”.
Dr Kucharczyk, autorka korespondencyjna publikacji, tłumaczy, że zespół wykorzystał system Split-GFP. Polega on na tym, że cząsteczkę białka GFP rozdzielono na dwa niefluorescencyjne fragmenty: pierwsze 10 beta-kartek cząsteczki GFP (GFP1-10) i ostatnią 11-tą beta kartkę (GFP11). Dopiero ich połączenie daje sygnał fluorescencji. Dotychczas w celu wizualizacji białek mitochondrialnych badacze wykorzystywali fragment GFP1-10, do którego dołączono sygnał kierujący go do mitochondriów. Drugi, brakujący fragment GFP11 dołączony był do badanych białek. Oba te fragmenty były syntetyzowane w cytoplazmie. Z tego powodu kompletowanie cząsteczki GFP i sygnał fluorescencji powstawały często zanim kierowane do mitochondriów GFP tam dotarło.
By wyeliminować ten problem, zespół stworzył szczep drożdży, do którego DNA mitochondrialnego został „dołożony” gen kodujący fragment białka GFP1-10, co powoduje, że wytwarzany jest on w mitochondriach tego szczepu. A zatem synteza obu fragmentów białka GFP jest od siebie oddzielona fizycznie. W ten sposób wyeliminowano problem uzyskania niespecyficznego sygnału fluorescencji, jaki istnieje przy dotychczasowych metodach badania lokalizacji białek mitochondrialnych wykorzystujących oba fragmenty GFP. Dodatkowym, niemniej ważnym atutem jest wizualizacja wyłącznie mitochondrialnej puli badanego białka.
Kiedy badane białko (wraz z fragmentem GFP11) trafia do środka mitochondrium, druga część „meduziego” białka łączy się z nim. I dopiero wtedy obserwujemy światło fluorescencji. W innych organellach komórkowych brakuje jednego elementu układanki (GFP1-10), więc pozostają one ciemne. I nie zaburzają wyników eksperymentu. To narzędzie umożliwiło autorom pracy udowodnienie mitochondrialnej lokalizacji białek, które do tej pory uważano za wyłącznie cytoplazmatyczne. Umożliwi ono też znaczny postęp w analizie mitoproteomów.
Opracowany przez naukowców szczep drożdży może służyć jako platforma do badań przesiewowych pod kątem mitochondrialnego „importowania” białek drożdży, ale także tych pochodzących z roślin i ludzi. Dr Kucharczyk ma nadzieję, że w przyszłości uda się rozwinąć ten pomysł tak, by wizualizować oddzielnie białka z macierzy mitochondrialnej i te z przestrzeni między błonami mitochondriów. Liczy też na to, że w dalszej przyszłości uda się stworzyć taki szczep, który pozwoli zobrazować jednocześnie pule danego białka w różnych organellach, każda świecąca na inny kolor. Inny kolor byłby więc dla frakcji cytoplazmatycznej, inny dla frakcji mitochondrilnej, a jeszcze inny dla frakcji wakuolarnej (nad Split-GFP do wizualizacji wakuoli zespół również rozpoczął już prace).
PAP - Nauka w Polsce, Ludwika Tomala
























KOMENTARZE