Hodowla roślin w warunkach in vitro to metoda opierająca się na wzroście komórek, tkanek lub organów roślinnych w sztucznych, kontrolowanych warunkach laboratoryjnych, z wykorzystaniem pożywek hodowlanych wzbogaconych o niezbędne składniki mineralne oraz witaminy. [1, 2] Pożywki wzbogacane są także o źródło węgla (najczęściej sacharozę) oraz regulatory wzrostu – auksyny i cytokininy. Ich obecność ma kluczowe znaczenie dla przebiegu całej hodowli. Auksyny, takie jak kwas indolilo-3-octowy (IAA), odpowiadają głównie za inicjację korzeni i stymulację podziałów komórkowych. Cytokininy, np. kinetyna czy benzylaminopuryna (BAP), pobudzają tworzenie pędów oraz opóźniają procesy starzenia się. Równowaga pomiędzy tymi hormonami determinuje kierunek rozwoju roślinnej kultury – czy będzie to wzrost niezróżnicowanej tkanki (kalusa), organogeneza, czy regeneracja całej rośliny. Te składniki wpływają nie tylko na strukturę rośliny, ale mogą również kierować szlakami metabolicznymi, co przekłada się na produkcję określonych rodzajów metabolitów wtórnych. [1, 3]
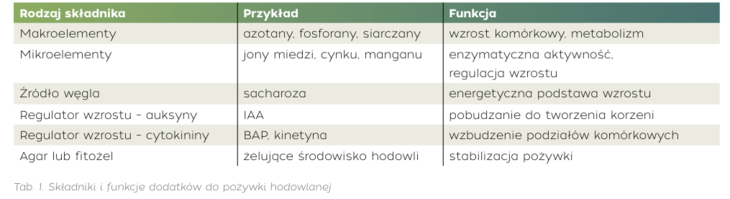
Niewątpliwą zaletą prowadzenia hodowli roślin w warunkach in vitro jest produkcja biomasy przez cały rok, niezależnie od pory roku, warunków atmosferycznych czy też lokalizacji geograficznej. Dzięki możliwości dostosowywania warunków wzrostu i prowadzenia hodowli możliwe jest nie tylko utrzymanie stałej produkcji biomasy, ale również optymalizacji procesu w celu zwiększenia produkcji pożądanych związków aktywnych. Do innych zalet tego rodzaju kultur zaliczyć można także możliwość uzyskania biomasy z gatunków, których występowanie ograniczone jest do specyficznych regionów geograficznych, a także roślin zagrożonych lub występujących wyłącznie na terenach objętych ścisłą ochrona prawną. Zmiany klimatyczne i zanieczyszczenie środowiska również nie mają wpływu na jakość uzyskanej metodami in vitro biomasy. [4, 5]
Metabolity wtórne roślin i ich rola w ochronie i pielęgnacji skóry
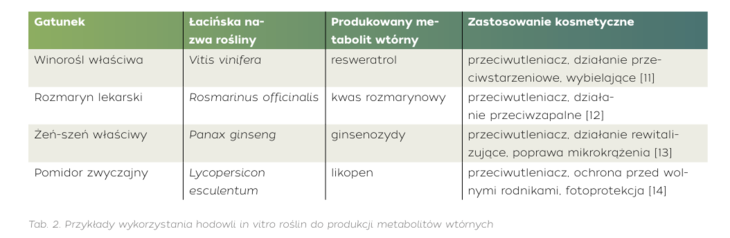
Metabolity wtórne roślin to organiczne związki chemiczne produkowane przez rośliny w odpowiedzi na działanie różnych czynników środowiskowych, takich jak: promieniowanie ultrafioletowe, zmiany temperatury, nadmiar soli w glebie, zanieczyszczenia atmosferyczne, infekcje patogenne czy niedobór składników mineralnych. [6] Rośliny aktywują wówczas mechanizmy obronne, w tym produkcję wtórnych metabolitów, np. flawonoidów, polifenoli, alkaloidów, terpenoidów czy glukozynolanów, które działają jako naturalne przeciwutleniacze, ochraniając komórki roślin. [7] W kosmetologii metabolity wtórne wykorzystywane są ze względu na swoje różnorodne właściwości, m.in. przeciwstarzeniowe, przeciwzapalne i fotoprotekcyjne. Związki, takie jak katechiny, kwas ferulowy, kwercetyna czy resweratrol, wspomagają neutralizację wolnych rodników, hamują degradację kolagenu i elastyny, a także wspierają regenerację skóry narażonej na działanie czynników środowiskowych. [8]
Roślinne kultury in vitro – narzędzie do wzbogacania biomasy w metabolity wtórne
Do produkcji metabolitów wtórnych możliwe jest wykorzystanie różnych typów kultur, które różnią się rodzajem eksplantatu lub warunkami prowadzenia hodowli. Są to m.in.: kultury kalusowe, zawiesinowe, organowe (np. korzeni lub pędów), transgeniczne. Szczególnie interesujące są te ostatnie, uzyskiwane przez transformację Agrobacterium rhizogenes (tzw. hairy roots), które charakteryzują się stabilnością genetyczną i metaboliczną oraz dużą produktywnością w przyroście biomasy. [9]
Możliwość optymalizacji warunków wzrostu kultur in vitro umożliwia kierowanie metabolizmem roślin w taki sposób, aby zwiększyć biosyntezę konkretnych metabolitów wtórnych, o interesujących dla człowieka właściwościach. W tym celu stosowane są różne zabiegi, m.in.: elicytacja, czyli dodanie stymulatorów pobudzających syntezę metabolitów wtórnych, optymalizacja składu pożywki, poprzez sterowanie dodatkami makro- i mikroelementów lub hormonów roślinnych, modyfikacje generyczne czy też zastosowanie czynników stresogennych (światła UV, zmian temperatury). [10] Hodowle komórek, zawiesin komórkowych, organów (np. korzeni, pędów) czy kalusa są szeroko stosowane do pozyskiwania bioaktywnych związków o zastosowaniu kosmetycznym.
Podsumowanie
Przedstawione przykłady udowadniają, że hodowla roślin w warunkach laboratoryjnych może stanowić jedno z kluczowych narzędzi biotechnologicznych, szczególnie w kontekście rosnącego zapotrzebowania na naturalne i bezpieczne substancje biologicznie czynne. Dzięki niej możliwa jest także ochrona zagrożonych gatunków roślin poprzez ich rozmnażanie oraz adaptacja biomasy w warunkach ex situ. W odpowiedzi na postępujące zmiany klimatyczne oraz coraz większą świadomość dotyczącą zrównoważonego gospodarowania zasobami naturalnymi hodowla roślin in vitro jest obiecującą alternatywą dla upraw tradycyjnych. To narzędzie pozwala na efektywną produkcję biomasy, ale także otwiera nowe ścieżki badawcze i przemysłowe w zakresie fitochemii i biotechnologii roślin. [15, 16]
Autorka: Mgr inż. Karolina Czech, doktorantka, asystentka w Katedrze Kosmetologii Wyższej Szkoły Informatyki i Zarządzania z siedzibą w Rzeszowie
























KOMENTARZE