Roztwór podchlorynu sodu (NaOCl), powszechnie znany jako roztwór Dakina, był stosowany w leczeniu ran już podczas I wojny światowej (1). W ostatnich 20 latach do lecznictwa zostały wprowadzone zaawansowane roztwory kwasu podchlorawego (HOCl) i podchlorynu sodu (NaOCl), których produkcja opiera się na nowoczesnych metodach elektrochemicznych – roztwory ponadtlenkowe. Szczególną rolę odgrywa tutaj kwas podchlorawy, który jest substancją występująca w komórkach człowieka i stanowi naturalny mechanizm obronny w przypadku ich uszkodzenia. Kwas podchlorawy (HOCl) charakteryzuje się nie tylko szerokim spektrum działania wobec różnych grup patogenów, tj. bakterii, w tym form przetrwalnikowych, wirusów i grzybów. Tworzy także warunki sprzyjające naturalnemu procesowi gojenia i jest dodatkowym źródłem tlenu dla rany. Podchloryny w postaci kwasu podchlorawego (HOCl) są bezpieczne, skuteczne w oczyszczaniu i dezynfekcji ran oraz wspomagają proces walki z zakażeniem (2, 3, 4).
w komórkach człowieka i stanowi naturalny mechanizm obronny w przypadku ich uszkodzenia. Kwas podchlorawy (HOCl) charakteryzuje się nie tylko szerokim spektrum działania wobec różnych grup patogenów, tj. bakterii, w tym form przetrwalnikowych, wirusów i grzybów. Tworzy także warunki sprzyjające naturalnemu procesowi gojenia i jest dodatkowym źródłem tlenu dla rany. Podchloryny w postaci kwasu podchlorawego (HOCl) są bezpieczne, skuteczne w oczyszczaniu i dezynfekcji ran oraz wspomagają proces walki z zakażeniem (2, 3, 4).
Miejscowa antyseptyka
Jedną ze skutecznych metod walki z infekcją w ranie jest stosowanie nowoczesnych lawaseptyków i antyseptyków o działaniu miejscowym. Łatwość dostępu do antyseptyków, wysoka tolerancja, brak podrażnień, niska cytotoksyczność oraz szerokie spektrum działania na drobnoustroje chorobotwórcze stawiają antyseptyki na pierwszej lini iw miejscowym leczeniu ran (4).
Antyseptyki dzielimy ze względu na ich mechanizm działania:

Roztwory podchlorynów dostępne są w preparatach na bazie podchlorynu sodu (NaOCl) lub/i kwasu podchlorawego (HOCl), które w kontakcie z drobnoustrojami wytwarzają reaktywne formy tlenu (4, 5). Badania wykazują skuteczność antyseptyków w zwalczaniu kolonizacji i zakażeń ran przewlekłych, a także kolonizacji implantów chirurgicznych (34).
Podchloryny – mechanizm działania
Jedną z funkcji układu immunologicznego jest obrona naszego organizmu przed działaniem patogenów. Układ immunologiczny wykorzystuje m.in. tworzenie reaktywnych form tlenu (ozon, rodniki hydroksylowe, nadtlenki), które są wytwarzane przez granulocyty obojętnochłonne (neutrofile) i limfocyty typu B. Kwas podchlorawy (HOCl) jest słabym kwasem mającym zdolności utleniające i bakteriobójcze, wytwarzanym w ludzkich neutrofilach w trakcie fagocytozy w celu eliminacji patogenów. Mechanizm działania kwasu podchlorawego (HOCl) oparty jest na wiązaniu się z białkami ściany komórkowej patogenów, doprowadzając do denaturacji i zwiększenia przepuszczalności komórki, co prowadzi do śmierci patogenu (6, 7). Mechanizm eliminacji bakterii i grzybów przy użyciu podchlorynów opiera się również na zjawisku osmolizy (rozerwania komórek). Roztwory podchlorynów mają właściwości hipotoniczne, co zwiększa napływ wody do wnętrza komórek bakterii, w celu wyrównania gradientu osmotycznego. Rezultatem tego procesu jest nagły wzrost ciśnienia wewnątrz komórki drobnoustroju, co doprowadza do jej dezintegracji. Proces ten nie zachodzi w komórkach człowieka, ze względu na ochronne działanie aminokwasów, takich jak tauryna, która rozkłada nadmiar kwasu podchlorawego (HOCl) oraz glutation (8). Oba mechanizmy zapewniają szybki efekt bakteriobójczy, grzybobójczy i wirusobójczy. Mechanizm działania ma charakter fizykalny, dlatego nie sprzyja powstawaniu oporności. Co ważne, kwas podchlorawy (HOCl) ma zdolność do wnikania w strukturę biofilmu, co ogranicza powstanie oporności bakterii na podchloryny (9).
 Zakres działania mikrobiologicznego
Zakres działania mikrobiologicznego
Nowoczesne roztwory podchlorynów są w stanie w bardzo krótkim czasie zmniejszyć stężenie drobnoustrojów i to w odniesieniu do bardzo szerokiego spektrum drobnoustrojów chorobotwórczych. Kwas podchlorawy (HOCl) zapobiega namnażaniu się bakterii Gram+ (w tym MRSA, VRSA, VRE), pałeczek Gram- (enterobakterie i niefermentujące), a także bakterii przetrwalnikowych oraz wirusów i grzybów (4, 10, 11). Działanie to wykazują zarówno roztwory kwasu podchlorawego (HOCl), jak i nasączone nim materiały, np. opatrunki ochronne. Roztwory podchlorynów NaOCl/HOCl są nieznacznie bardziej skuteczne w eliminacji biofilmu bakteryjnego w porównaniu do PHMB/betadyny (12, 13).
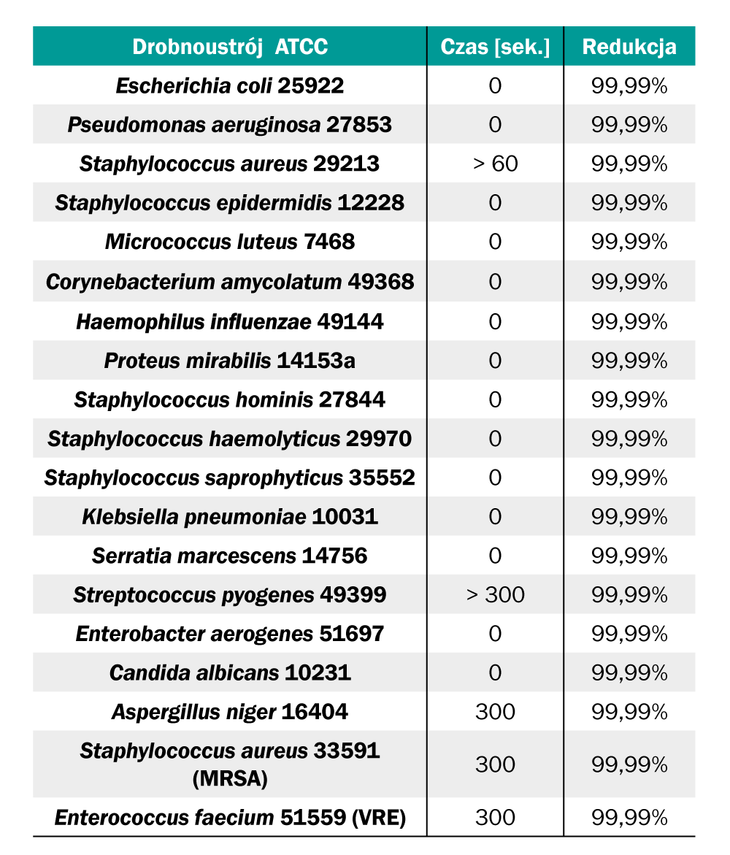
Publikacje wskazują również, że kwas podchlorawy (HOCl) w niskich stężeniach wykazuje silną aktywność mikrobiologiczną przy jednoczesnym braku działania cytotoksycznego na ludzkie keratynocyty i fibroblasty, nie blokując ich migracji i proliferacji, co umożliwia przyspieszenie naturalnego procesu gojenia się rany (10, 14). Działanie antyseptyku w badaniach in vitro wskazuje na szybką eliminację wielu szczepów bakterii patogennych (Tabela 1.).
Tabela 1. Czas potrzebny do eliminacji patogenów przy użyciu roztworu HOCl (130 ppm) (11, 14)
Biofilm
Coraz większą rolę w patogenezie zakażeń odgrywa zdolność drobnoustrojów do tworzenia biofilmu. Biofilm tworzy się na powierzchni ran (w postaci zorganizowanych struktur) i może być mikrobakteryjny, wielobakteryjny, a także mieszany – bakteryjno-grzybiczy. Biofilm jest znacznie mniej wrażliwy na działanie antybiotyków, antyseptyków oraz mechanizmów obronnych ludzkiego organizmu. Zakażenia związane z biofilmem prowadzą do zmniejszenia skuteczności leczenia, dalszego rozwoju infekcji ze względu na niewystarczające przenikanie substancji antybakteryjnych czy przeciwgrzybiczych, a także fagocytów (15, 16, 17).
Kwas podchlorawy (HOCl) wykazuje dużą skuteczność w stosunku do drobnoustrojów Gram+ i Gram- oraz grzybów. Ponadto, jest aktywny wobec szczepów Staphylococcus aureus opornych na metycylinę (18). Wykazano, że nawet niskie stężenia kwasu podchlorawego (HOCl) w przedziale od 5,5 do 11 μg/μl są w stanie znacząco zmniejszyć przeżywalność Pseudomonas aeruginosa w biofilmie przy 30 minutach ekspozycji.
W innych badaniach potwierdzono działania kwasu podchlorawego (HOCl) na Staphylococcus aureus, obniżając stężenie bakterii o 5 w skali logarytmicznej w przeciągu zaledwie 1 minuty i o 6 w skali logarytmicznej przy 10-minutowej ekspozycji na biofilm. W badaniu tym doszło do ponad 70% redukcji biofilmu, a ponad 90% białek biofilmu zostało zredukowanych przy 10-minutowej ekspozycji kwasu podchlorawego (HOCl) (19,20).
Zważywszy na wysoką tolerancję kwasu podchlorawego (HOCl), w nowoczesnych roztworach do przemywania i dezynfekcji ran zaleca się 10-minutowe stosowanie podchlorynów w redukcji i usuwaniu biofilmu w ranie. Inną cechą wpływającą na komfort pacjenta i personelu medycznego jest eliminacja nieprzyjemnego zapachu z rany przy użyciu roztworów na bazie podchlorynów.
Bezpieczeństwo
Podchloryny znajdują szerokie zastosowanie w:
* stomatologii,
* laryngologii,
* dermatologii,
* ginekologii,
* leczeniu ran przewlekłych i zakażonych, tj.:
- odleżyn,
- owrzodzeń,
- zespołu stopy cukrzycowej,
- oparzeń termicznych i popromiennych,
- ran pooperacyjnych.
Podchloryny w postaci podchlorynu sodu (NaOCl), jako środka do leczenia ran, po raz pierwszy zastosowano w trakcie I wojny światowej, jeszcze przed wprowadzeniem antybiotyków.
W warunkach fizjologicznych stężenie kwasu podchlorawego (HOCl), jako naturalnej substancji, nie przekracza 0,002% w ludzkich komórkach, a w dostępnych antyseptykach, tj.: Microdacyn®, Granudacyn®, Granusept®, użyte stężenia wahają się od 0,008% do 0,016%, co odpowiada od 4- do 6-krotnie wyższym stężeniom, w porównaniu z możliwościami wytwarzania przez układ immunologiczny człowieka (11).
Podchloryny w tym zakresie stężeń nie wykazują działania cytotoksycznego i mogą być stosowane do:
* przemywania ran chirurgicznych,
* ran przewlekłych,
* owrzodzeń podudzi,
* stopy cukrzycowej,
* przemywania włókien nerwowych,
* ścięgien,
* powięzi czy rogówki oka (21-28, 35).
Kwas podchlorawy (HOCl) w niskich stężeniach nie zmniejsza też migracji i proliferacji fibroblastów w ranie, co jest szczególnie ważne w zachowaniu naturalnego procesu gojenia. Roztwory te są też bezpieczne i zalecane w terapii podciśnieniowej (NPWT). Cechą szczególną podchlorynów, ze względu na wysoką biozgodność tkankową, jest brak konieczności wymywania roztworów z ran, przetok czy jam ciała (4). Preparaty o starszej technologii, gdzie stężenia podchlorynów wahają się od 0,03% do 0,06%, tj.: Aqvitox®, Lavanox® (30), mogą być również stosowane do wszystkich rodzajów ran, z wyłączaniem przemywania włókien nerwowych, oka, ścięgien czy też terapii podciśnieniowej. Podchloryn sodu (NaOCl) jest również stosowany jako monopreparat i jego użyteczne i dopuszczalne stężenie, jako pojedynczej substancji, to poniżej 0,06% (4).
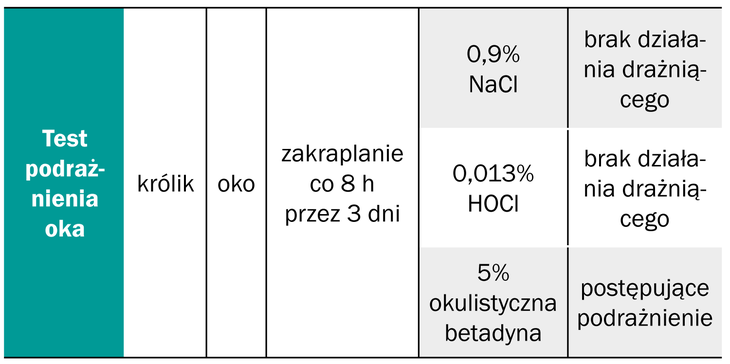
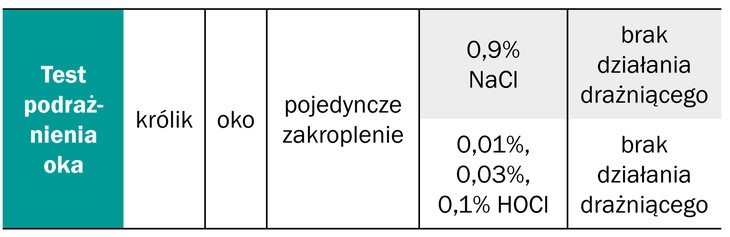
W przypadku roztworów, których skład opiera się na kwasie podchlorawym (HOCl), który jest naturalnie wytwarzany przez układ immunologiczny człowieka, tolerancja jest wyższa niż mieszanek podchlorynu sodu (NaOCl) i kwasu podchlorawego (HOCl). Przetestowano, na różnych modelach klinicznych, cytotoksyczność kwasu podchlorawego (HOCl) w porównaniu do 0,9% podchlorynu sodu (NaOCl) oraz ocznego roztworu betadyny. Stabilizowany roztwór kwasu podchlorawego (HOCl) w stężeniu 0,013% i 0,016% podawany na rogówkę oka, co 8 godzin przez 3 dni, nie wykazywał działania drażniącego na oko i spojówkę królika. Tolerancja kwasu podchlorawego (HOCl) była na poziomie 0,9% roztworu soli fizjologicznej i okazała się znacznie wyższa niż roztworu okulistycznego betadyny, która wykazywała działanie drażniące (3, 10, 31).
Inny test, dotyczący pojedynczego zakraplania na rogówkę oka kwasu podchlorawego (HOCl) w stężeniach 0,01%, 0,03% i 0,1%, również nie powodował podrażnień na modelu zwierzęcym (Tabela 2.).
Tabela 2. Badania bezpieczeństwa stosowania roztworu HOCl

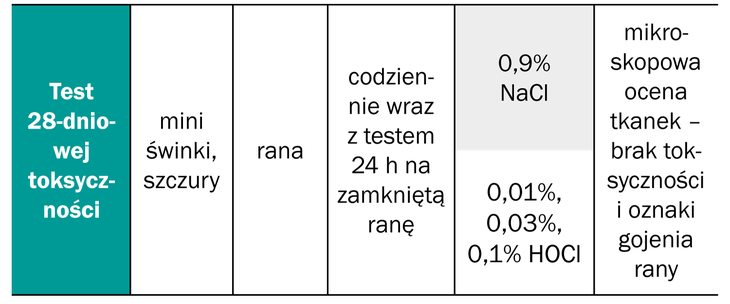
Kwas podchlorawy (HOCl) w stężeniach 0,03% i 0,1% nie powodował podrażnień skóry na modelach doświadczalnych w przypadku testu cytotoksyczności trwającego 28 dni na modelach komórkowych. W stężeniu nieprzekraczającym 0,1% roztworu stabilizowanego na kwasie podchlorawym (HOCl) nie wykazano cytotoksyczności miejscowej ani ogólnoustrojowej (10, 31, 32).
Wysoką tolerancję i biozgodność tkankową tego typu roztworów można przypisać naturalnej obecności tego związku w komórkach układu immunologicznego oraz wytwarzaniu przez nasz organizm mechanizmów obronnych powodujących rozkład tego związku w nadmiarze.
W przypadku roztworów podchlorynów opartych na mieszankach podchlorynu sodu (NaOCl) i kwasu podchlorawego (HOCl) za granicę wysokiej tolerancji i braku cytotoksyczności można uznać roztwory w stężeniach do 0,025% (4, 8, 11).
Podchloryny i kwas podchlorawy w leczeniu ran
Według rekomendacji Europejskich Towarzystw Naukowych z 2018 r. oraz Polskiego Towarzystwa Leczenia Ran z 2019 r., nowoczesne roztwory podchlorynów w niskich stężeniach mogą być stosowane do przemywania każdego typu rany, przetok, powięzi, ścięgien i kości, bez konieczności wymywania ich z rany (33).
Podchloryny ze względu na swoje właściwości znajdują zastosowanie w: laryngologii, stomatologii, ginekologii, okulistyce, neurochirurgii oraz w chirurgii ogólnej, bez ograniczeń wiekowych.
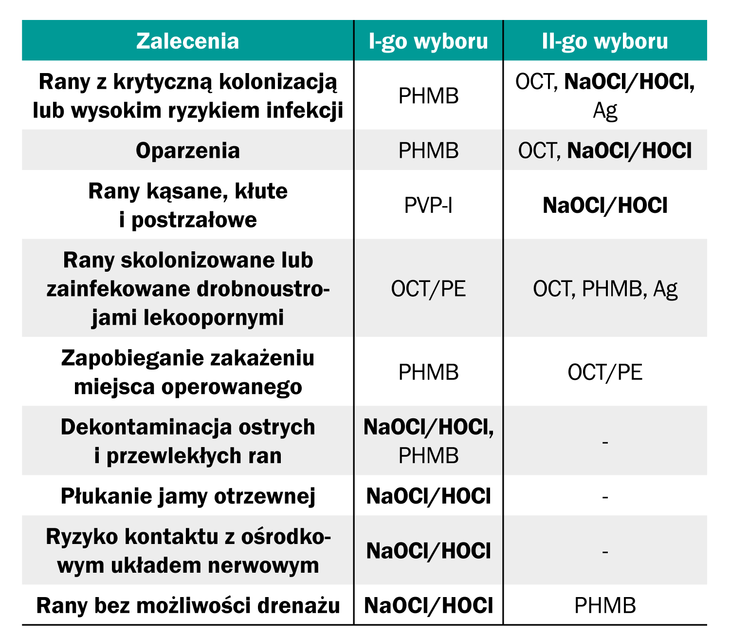
Podchloryny jako miejscowy antyseptyk pierwszego rzutu są rekomendowane przez europejskich ekspertów do przemywania:
* ran ostrych i przewlekłych,
* włókien nerwowych,
* przetok i ran, bez możliwości drenażu
oraz jako produkt drugiego wyboru w:
* ranach krytycznie skolonizowanych z wysokim ryzykiem infekcji,
* ranach kłutych,
* ranach kąsanych,
* ranach postrzałowych,
* oparzeniach (Tabela 3.).
Tabela 3. Antyseptyki I i II wyboru w różnych sytuacjach klinicznych (4)
Według konsensusu Kramera z 2018 r., podchloryny i kwas podchlorawy (HOCl) znalazły szerokie zastosowanie w różnych sytuacjach klinicznych dotyczących odkażania i leczenia ran (4). Skuteczność oraz bezpieczeństwo stosowania, dobra tolerancja, brak cytotoksyczności i działań niepożądanych umożliwia zastosowanie podchlorynów w codziennej praktyce, zarówno w lecznictwie otwartym, jak i szpitalnym (Tabela 4.).
Dobrą tolerancję i skuteczność kwasu podchlorawego (HOCl) potwierdzono również po zabiegach cięcia cesarskiego. Wykazano bezpieczeństwo, wysoką skuteczność i szybsze gojenie się rany pooperacyjnej niż po zastosowaniu roztworu jodopowidonu (PVP-I) (29).
Tabela 4. Charakterystyka zastosowań klinicznych wybranych antyseptyków (4)
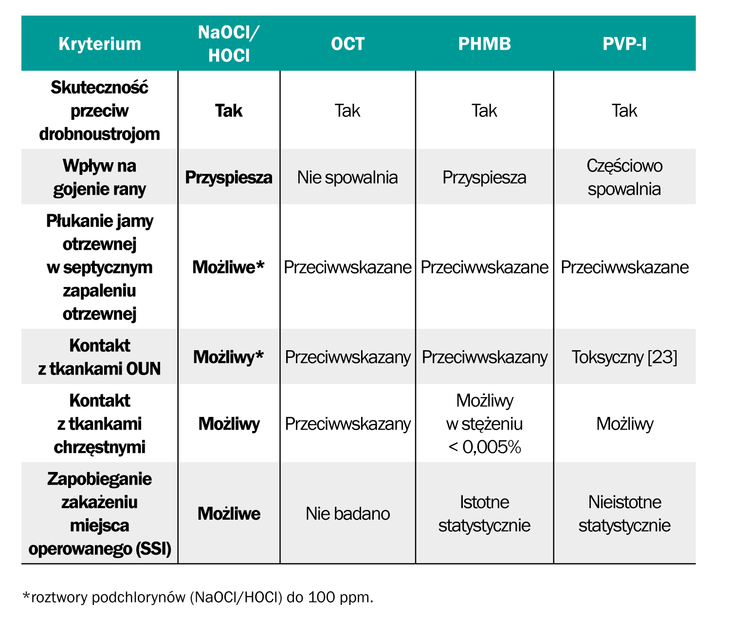
Podsumowanie
Wprowadzenie nowych produktów do dezynfekcji i odkażania ran jest ważnym elementem strategii walki z narastającą lekoopornością na antybiotyki i antyseptyki. Nie ma uniwersalnego środka do odkażania ran, któremu możemy przypisać 100% tolerancję i skuteczność działania, dlatego warto zamiennie sięgać po przebadane i dopuszczone do obrotu produkty, które mają na celu eliminację chorobotwórczych patogenów.
Roztwory podchlorynów, a szczególnie kwas podchlorawy (HOCl), zyskał uznanie u ekspertów zarówno w Stanach Zjednoczonych, jak i Europie, gdzie od 2018 r. na stałe znalazł miejsce w odkażaniu i leczeniu ran o różnej etiologii. Podchlorynom można przypisać dużą skuteczność w eliminacji bakterii, grzybów i wirusów oraz w zapobieganiu i eliminacji bakteryjnego biofilmu w ranie. Nowoczesne roztwory, w stężeniach od 0,008% do 0,016%, wykazują wysoką biozgodność tkankową, przyspieszają proces leczenia ran, mają właściwości nawilżające i są hipoalergiczne, co umożliwia bezpieczne ich stosowanie bez ograniczeń wiekowych.
Biorąc pod uwagę komfort pacjenta, nowoczesne roztwory kwasu podchlorawego (HOCl) nie muszą być wymywane z rany, ograniczają ból przy zmianie opatrunków oraz eliminują nieprzyjemny zapach z rany.
Autorka: Prof. dr hab. n. med. Waleria Hryniewicz,
Zakład Epidemiologii i Mikrobiologii Klinicznej,
Narodowy Instytut Leków, Warszawa
--
1. Levine J.M.: Dakin’s solution: Past, present, and future. Adv Skin Wound Care. 2013;26(9):410-414.
2. Souza C.E., Maitra D., Saed G.M. i wsp.: Hypochlorous acid-inducedheme degradation from lactoperoxidase as a novel mechanism offree iron release and tissueinjury in inflammatory diseases. PLoS One 2011;6(11):e27641.
3. Armstrong D.G., Bohn G., Glat P. i wsp.: Expert Recommendations forthe use of Hypochlorous Solution: SCIENCE AND CLINICAL APPLICATION: Ostomy Wound Management. Wounds May 2015.
4. Kramer A., Dissemond J., Kim S. i wsp.: Consensus of Wound Antisepsis; Update 2018, Skin Pharmacol Physiol 2018;31:28-58.
5. Selkon J.B., Babb J.R., Morris R.: Evaluation of the antimicrobial activityof a new super-oxidized water, SteriloxR, for the disinfection of endoscopes. J Hosp Infect. 1999;41(1):59-70.
6. Pullar J.M., Vissers M.C., Winterbourn C.C.: Living with a killer: The effects of hypochlorous acid on mammalian cells. IUBMB Life; 2000;50(4-5):259-266.
7. Fu X., Kassim S.Y., Parks W.C., Heinecke J.W.: Hypochlorous acid generated by myeloperoxidase modifies adjacent tryptophan and glycineresidues in the catalytic domain of matrix metalloproteinase-7(matrilysin): an oxidative mechanism for restraining proteolytic activity during inflammation. J Biol Chem. 2003;278(31):28403-28409.
8. Szkiler E.: Podchloryny w leczeniu owrzodzeń. Fakty i Mity. Forum Zakażeń 2017;8 (4): 285-289.
9. Küster I., Kramer A., Bremert T. i wsp.: Eradication of MRSA skullbase osteitis by combined treatment with antibiotics and sinonasalirrigation with sodium hypochlorite. Eur Arch Otorhinolaryngol 2016;273(7):1951-1956.
10. Sakarya S., Gunay N., Karakulak M. i wsp.: Hypochlorous acid: anideal wound care agent with powerful microbicidal, antibiofilm, and wound healing potency. WOUNDS. 2014;26(12):342-350.
11. Wang L., Bassiri M., Najafi R. i wsp.: Hypochlorous acid as a potential wound care agent. Part I. Stabilized Hypochlorous acid: A componentof the inorganic armamentarium of innateimmunity. J Burns Wounds. 2007.
12. James G.A., Swogger E., Wolcott R. i wsp.: Biofilms in chronic wounds. Wound Repair Regen. 2008;16(1):37-44.
13. D’Atanasio N., Capezzone de Joannon A., Mangano G. i wsp.: A new acid-oxidizing solution: assessment of its role on methicillinresistant Staphylococcus aureus (MRSA) biofilm morphological changes. Wounds 2015; 27: 265-273.
14. Armstrong D.G., Bohn G., Glat P. i wsp.: Expert Recommendations for the use of Hypochlorous Solution: SCIENCE AND CLINICAL APPLICATION: Ostomy Wound Management. Wounds May 2015.
15. Bartoszewicz M., Rygiel A.: Biofilm jako podstawowy mechanizm zakażenia miejsca operowanego – metody prewencji w leczeniu miejscowym. Chirurgia Polska 2006, 8, 3.
16. Maciejewska M., Bauer M., Dawgul M.: Nowoczesne Metody Zawalczenia Biofilmu. Postępy Mikrobiologii 2016, 55, 1,3-11.
17. Anderl J.N., Zahller J., Roe F., Stewart P.S.: Role of nutrient limitation and stationary-phase existence in Klebsiella pneumoniae biofilm resistance to ampicillin and ciprofloxacin. Antimicrob Agents Chemother. 2003;47(4):1251-1256.
18. Sauer K., Thatcher E., Northey R., Gutierrez A.A.: Neutral super-oxidized solutions are effective in killing P. aeruginosa biofilms. Biofouling. 2009;25(1):45-54.
19. Robson M.C.: Treating chronic wounds with hypochlorous acid disrupts biofilm. Today’s Wound Clinic. 2014;8(9):20-21.
20. Sakarya S. Gunay N., Karakulak M. i wsp.: Hypochlorous acid: an ideal wound care agent with powerful microbicidal, antibiofilm, and wound healing potency. WOUNDS. 2014;26(12):342-350.
21. Piaggesi A., Goretti C., Mazzurco S. i wsp.: A randomized controlled trial to examine the efficacy and safety of a new super-oxidized solution for the management of wide postsurgical lesions of the diabetic foot. Int J Low Extrem Wounds. 2010;9(1):10-15.
22. Hadi S.F., Khaliq T., Bilal N. i wsp.: Treating infected diabetic wounds with super-oxidized water as anti-septic agent: a preliminary experience. J Coll Physicians Surg Pak. 2007;17(12):740-743.
23. Chittoria R.K., Yootla M., Sampatrao L.M., Raman S.V.: The role of super-oxidized solution in the management of diabetic foot ulcer: our experience. Nepal Med Coll J. 2007;9(2):125-128.
24. Selkon J.B., Cherry G.W., Wilson J.M., Hughes M.A.: Evaluation of hypochlorous acid washes in the treatment of chronic venous leg ulcers. J Wound Care. 2006;15(1):33-37.
25. Mohd A.R., Ghani M.K., Awang R.R. i wsp.: Dermacyn irrigation in reducing infection of a median sternotomy wound. Heart Surg Forum. 2010;13(4):E228-E232.
26. Anand A.: Comparative efficacy and tolerability of Oxum against povidone-iodine topical application in the post-caesarian section wound management. Indian Med Gaz. 2007; December:498-505.
27. Abhyankar S.V., Venkatesh V., Karnad S. i wsp.: Efficacy and safety of oxum in treatment of chronic wounds. J Indian Med Assoc. 2009;107(12):904-906.
28. Kapur V., Marhawa A.K.: Evaluation of effect and comparison of superoxidised solution (Oxum) V/S povidone iodine (Betadine). Indian J Surg. 2011;73(1):48-53.
29. Anand A.: Departament of Obstetrics & Gynaecology. Comperative Efficacy and Tolerability of Oxum against Povidone Iodine Topical Application in the Post-caesarian Section Wound Management. Indian Medical Magazine. December 2007.
30. Ulotka produktowa Laxanox-Serag® wound spray gel.
31. Ocular Irritation Study Granusept® American Preclinica Study (APS) Final Report: STUDY ID: MFY005-IR99.
32. Buehler Test Granusept®. American Preclinica Study (APS) Final Report. StudyNumber: MFY001-BC02.
33. Wytyczne postępowania miejscowego i ogólnego w ranach objętych procesem infekcji. Stanowisko Ekspertów Polskiego Towarzystwa Leczenia Ran. Leczenie Ran 2019.
34. Granick M.S., Paribathan C., Shanmugam M., Ramasubbu N.: Direct-contact low-frequency ultrasound clearance of biofilm from metallic implant materials. Eplasty 2017;17:128-134.
35. Dzikowska M., Wojtas K., Kózka M.: Podchloryny w leczeniu ran przewlekłych. Zakażenia XXI wieku 2018;1(6).
























KOMENTARZE