Postępy w selekcji genetycznej ptaków wraz z odpowiednimi programami żywieniowymi były głównymi czynnikami napędzającymi rozwój sektora drobiarskiego w ostatnich dziesięcioleciach. W wyniku tego postępu potrzeba tylko 35 dni, aby nowoczesna linia komercyjnych brojlerów hodowlanych osiągnęła masę rynkową (ok. 2,2 kg), zużywając jedynie 1,5 kg paszy na 1 kg przyrostu masy ciała, podczas gdy kilka dekad temu czas żywienia wymagany do osiągnięcia takiej masy ciała wynosił kilka miesięcy. Tak więc kurczęta brojlery stanowią gatunek zwierząt hodowanych intensywnie. Negatywną konsekwencją selekcji genetycznej przeprowadzonej w celu osiągnięcia szybszych wskaźników wzrostu i lepszego wykorzystania paszy jest pogorszenie dobrostanu zwierząt, co objawia się zwiększonymi nieprawidłowościami zdrowotnymi i problemami związanymi z jelitami, zmniejszoną odpornością na czynniki stresowe i osłabieniem cech metabolicznych warunkujących jakość i właściwości fizykochemiczne mięsa. Może to także prowadzić do skażenia produktów końcowych (tuszy, podrobów), przeznaczonych do spożycia przez ludzi. Konsekwencje te stanowią główne obawy w produkcji brojlerów. Od momentu wprowadzenia przez wiele państw na świecie (w tym także w UE) prewencyjnego stosowania antybiotyków i antybiotykowych stymulatorów wzrostu w produkcji drobiarskiej występowanie chorób jelitowych u ptaków znacznie się nasiliło – głównie z powodu braku alternatywnej profilaktyki.
Do powszechnie występujących patogenów odpowiedzialnych za choroby jelitowe u kurcząt zaliczane są bakterie Clostridium perfringens wywołujące nekrotyczne zapalenie jelit (necrotic enteritis – NE) w najbardziej rozwiniętym stadium chorobowym. Największe straty dla produkcji drobiarskiej i zarazem zagrożenie dla konsumentów stanowi jednak subkliniczne zakażenie ptaków bakteriami C. perfringens (tj. takie, które nie powoduje skutków letalnych). Wynika to z tego, że zainfekowane ptaki przechodzące subkliniczną postać NE zwykle nie przejawiają oznak choroby, więc nie są usuwane z cyklu produkcyjnego i poprzez pogorszone wyniki odchowu generują straty produkcyjne dla hodowcy oraz stanowią potencjalny nośnik toksyn bakterii C. perfringens w produkcie końcowym, przeznaczonym do spożycia przez konsumentów. Potwierdza to ostatni raport Europejskiej Agencji Leków (EMA/24309/2020), który donosi, że niezdiagnozowane problemy zdrowotne kurcząt są przyczyną ogromnych kosztów ekonomicznych w sektorze drobiarskim i znacząco przyczyniają się do globalnego zagrożenia zdrowia publicznego.
Zdolność bakterii C. perfringens do kolonizacji przewodu pokarmowego ptaków zależy od wielu czynników, m.in. zawartości białka i rozpuszczalnego włókna w diecie (im większy ich poziom, tym więcej niestrawionych substratów jest wykorzystywanych przez bakterie do procesów fermentacyjnych/namnażania), warunków sanitarnych w kurniku (głównie wilgotności ściółki, gdyż zwiększony poziom wilgotności sprzyja ich namnażaniu) oraz wystąpienia innych czynników infekcyjnych (szczególną rolę w zwiększeniu występowania NE odgrywa jednoczesne zakażenie kokcydiami), dlatego też pełne zrozumienie patogenezy C. perfringens u kurcząt brojlerów jest trudnym zadaniem.
Z tego względu badania prowadzone w różnych ośrodkach na świecie (m.in. w Kanadzie, Australii czy Belgii) dotyczące zrozumienia patogenezy NE u drobiu przynoszą sprzeczne wyniki, co utrudnia opracowanie skutecznej profilaktyki. Naukowcom z Instytutu Fizjologii i Żywienia Zwierząt im. Jana Kielanowskiego PAN w Jabłonnie oraz Katedry Drobiarstwa i Pszczelnictwa UWM w Olsztynie w warunkach doświadczalnych udało się zoptymalizować czynniki do wywoływania u kurcząt subklinicznej formy NE. Do tego celu, oprócz zmodyfikowanego składu diet doświadczalnych podawanych ptakom, wykorzystywane są inaktywowane szczepionki zawierające kokcydia (E. acervulina, E. maxima, E. mitis, E. praecox, E. tenella) oraz hodowle szczepów bakterii C. perfringens (CP56 i wyizolowane szczepy polowe). W doświadczeniach przeprowadzonych w warunkach in vivo wykazano, że u ptaków zakażanych bakteriami C. perfringens w wyżej opisanym modelu doświadczalnym nie wystąpiły zmiany charakterystyczne dla ostrej fazy nekrotycznego zapalenia jelit i jednocześnie zastosowany model zakażenia nie spowodował wzrostu upadków ptaków.
Wyniki badań z ostatnich lat wskazują, że procesy zapalne u kurcząt wywołane różnymi czynnikami stresogennymi mogą być w pewnym stopniu kontrolowane przy zastosowaniu substancji o działaniu bioaktywnym. Szczególnym zainteresowaniem cieszą się związki wspomagające stan funkcjonalny przewodu pokarmowego kurcząt, który wraz z zasiedlającą go mikroflorą stanowi pierwszą linię obrony przeciwko patogenom oraz warunkuje odpowiedź immunologiczną. Dlatego poprzez skuteczne wspomaganie bariery jelitowej stwarza się możliwość efektywnego wzmocnienia odporności kurcząt na czynniki stresowe. Ostatnie wyniki doświadczeń wykazały, że potencjalnym regulatorem oddziałującym na układ pokarmowy, w tym także na zasiedlającą go mikroflorę bakteryjną, jest kannabidiol (CBD) oraz jego prekursor – kwas kannabinoidowy (CBDA) zawarty w konopiach włóknistych (Cannabis sativa). Pomimo iż badania potencjału CBD nie zostały jeszcze w pełni wyjaśnione oraz dotyczą głównie medycyny ludzkiej lub warunków in vitro, jego właściwości regulujące procesy umożliwiające integralność jelit skłaniają do dalszych analiz.
Aktywność biologiczna CBD polega na aktywacji specyficznych receptorów systemu endokannabinoidowego (CB1 i CB2), które są zlokalizowane centralnie i obwodowo w całym organizmie. Ponieważ oba receptory są odpowiedzialne za utrzymanie homeostazy, w tym m.in. regulację przyjmowania pokarmu i motoryki przewodu pokarmowego czy transport jonów, możliwość ich regulacji może być skuteczną interwencją w leczeniu stanu zapalnego jelit. W badaniach własnych wykazano korzystny wpływ CBD na stan funkcjonalny przewodu pokarmowego u kurcząt zakażanych bakteriami C. perfringens (schemat poniżej). W doświadczeniu udowodniono, że podawanie w diecie ekstraktu z konopi zawierającego CBD spowodowało zwiększoną ekspresję mRNA genów kodujących białka w ścisłych połączeniach komórek nabłonka jelit (m.in. GLP-2, JAM-2, ZO-1, TLR-4), białek związanych z naprawą uszkodzeń DNA w tkance jelita (TFF-2), a także miało istotny wpływ na aktywność mikroflory bakteryjnej w jelicie ślepym u kurcząt zakażanych w porównaniu do grupy niezakażanej.
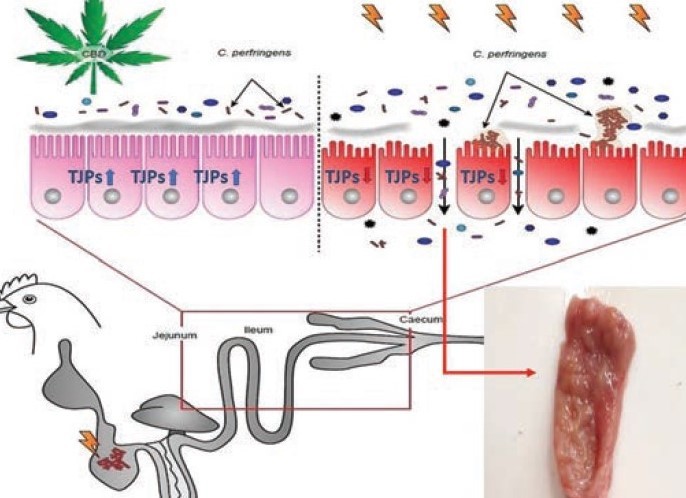
Źródło: Konieczka et al., 2020
Ze względu na wysoki koszt pozyskania ekstraktu CBD z konopi oraz regulacje prawne związane z wykorzystaniem produktów pochodzących z konopi w żywieniu i/lub leczeniu zwierząt (obecnie w Polsce nie wolno stosować surowców z konopi jako leków dla zwierząt), upłynie sporo czasu, zanim będzie można bezpośrednio wykorzystać CBD w profilaktyce NE spowodowanego bakteriami C. perfringens u drobiu. Obecne badania prowadzone są w kierunku zrozumienia specyficznego mechanizmu działania CBD na procesy warunkujące integralność jelit (głównie na poziomie molekularnym). Odkrycie tych mechanizmów być może pozwoli przenieść je także do innych modeli badawczych, w których obserwowany jest wpływ indukowanego stresu na procesy warunkujące stan funkcjonalny przewodu pokarmowego. Dokładne zrozumienie sposobu działania CBD na procesy fizjologiczne w przewodzie pokarmowym natomiast mogłoby zapoczątkować badania nad wykorzystaniem alternatywnych (być może znacznie tańszych i bardziej aplikacyjnych – np. syntetycznych odpowiedników) substancji o podobnym działaniu.
Badania finansowane przez Narodowe Centrum Nauki, Projekt nr 2018/29/B/NZ9/01351.
Autorzy: Misza Kinsner, Paweł Konieczka i Dominika Szkopek
























KOMENTARZE