Fot. Dr Bartłomiej Tomasik, źródło: Paweł Sudara/GUMed
– W latach 2020-2021 w ramach stażu podoktorskiego realizowanego m.in. dzięki wsparciu Narodowej Agencji Wymiany Akademickiej i programowi im. prof. Walczaka pracowałem w Division of Radiation and Genome Stability, Department of Radiation Oncology, Dana-Farber Cancer Institute, Harvard Medical School. Od tamtej pory ściśle współpracuję z dwoma zespołami, którymi kierują prof. Dipanjan Chowdhury oraz prof. Alexander Spektor. Powyższa publikacja stanowi owoc współpracy tych dwóch zespołów. Mój udział w projekcie dotyczył przede wszystkim eksperymentów związanych z oceną zmian fosforylacji białek biorących udział w mitozie w odpowiedzi na zahamowanie CDK5 – mówi dr Bartłomiej Tomasik.
Kluczowymi regulatorami cyklu komórkowego są kinazy zależne od cyklin (CDKs) oraz ich aktywatory – cykliny. Przez lata uważano, że CDK5 jest „nietypowa” ze względu na jej aktywację przez białka nienależące do cyklin (p35 oraz p39) oraz fizjologiczne występowanie jedynie w komórkach nerwowych, które nie ulegają podziałom. Z tego powodu CDK5 uważana była za CDK niezwiązaną z cyklem komórkowym. Jednocześnie istniały doniesienia wskazujące, że CDK5 występuje w nadmiarze w wielu nowotworach i może napędzać proliferację komórek nowotworowych, ale sposób, w jaki CDK5 miałaby regulować proliferację tych komórek, pozostawał niejasny. W omawianej pracy wykazano, że CDK5 odgrywa kluczową rolę w mitozie. Aby to osiągnąć, badacze zastąpili natywną CDK5 wariantem, który specyficznie wiąże się z substancjami hamującymi lub degradującymi CDK5 przed wejściem komórek w mitozę. Naukowcy udowodnili, że komórki pozbawione CDK5 wykazują zaburzenia wrzeciona mitotycznego, czyli struktury, na której powielone chromosomy poruszają się podczas podziału komórek. W efekcie chromosomy nie mogą być prawidłowo rozprowadzane do komórek potomnych, co skutkuje genetycznie niestabilnymi komórkami potomnymi i prowadzi do tworzenia nieprawidłowych struktur jądrowych, takich jak np. mikrojąderka. Co zaskakujące, okazało się, że CDK5 działa poprzez współpracę z cykliną B1 – tą samą cykliną mitotyczną, która współdziała z CDK1, kluczowym regulatorem mitozy, we wszystkich etapach podziału komórkowego. Tym samym badacze wykazali, że CDK5 należy do kanonicznych kinaz regulujących cykl komórkowy i jest niezbędna do utrzymania stabilności genomu.
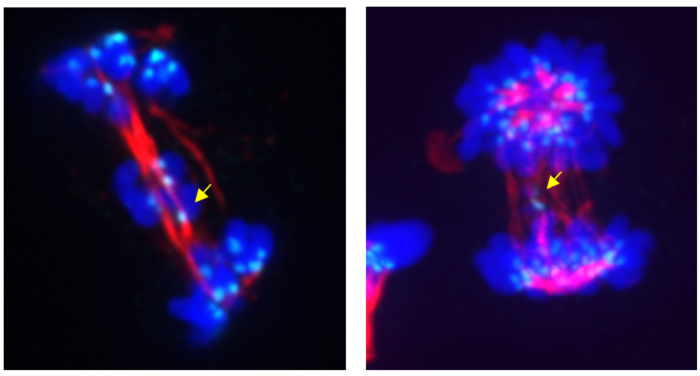
Fot. Nieprawidłowy podział komórkowy na skutek hamowania (lewy panel) lub degradacji (prawy panel) CDK5 – żółtymi strzałkami zaznaczono chromosomy, które podczas anafazy nie przemieściły się do komórek potomnych (z ang. lagging chromosomes). Kolor turkusowy reprezentuje przeciwciała przeciwcentromerowe (z ang. anti-centromere antibodies, ACA), które reagują z jednym z białek tworzących centromer, tzw. centromerowym białkiem B (CENP-B). Kolor czerwony reprezentuje tubulinę wchodzącą w skład wrzeciona podziałowego, a kolor niebieski reprezentuje barwnik Hoechst służący do wybarwiania DNA. Źródło: GUMed
Znaczenie odkrycia
To odkrycie zmienia istniejący dogmat biologii molekularnej mówiący o tym, że kompleks CDK1-cyklina B1 jest jedynym niezbędnym dla wszystkich etapów mitozy. Uzyskane wyniki sugerują, że inne, pozornie atypowe CDKs, mogą również pełnić funkcję regulacji cyklu komórkowego. Badacze wykazali znaczenie kompleksu CDK5-cyklina B1 podczas fizjologicznego podziału komórkowego, jednak ten kompleks może odgrywać jeszcze większą rolę w szybko proliferujących komórkach nowotworowych. CDK5 ulega bowiem nadmiernej ekspresji i aktywacji w szerokim spektrum nowotworów i jest to związane z niekorzystnym rokowaniem. Sugeruje to, że rozwój wielu nowotworów może być zależny od poziomu CDK5. Dlatego, podobnie jak istniejące terapie ukierunkowane na CDKs (inhibitory CDK4/6 stosowane w leczeniu raka piersi), CDK5 może być w przyszłości ważnym celem terapeutycznym w leczeniu raka.
Doktor Bartłomiej Tomasik jest współkoordynatorem zespołu badawczego IDUB zajmującego się biologicznymi i fizycznymi aspektami promieniowania jonizującego oraz ich przełożeniem na praktykę kliniczną. Grupa aktywnie poszukuje partnerów do dalszych działań naukowych. Osoby zainteresowane współpracą mogą uzyskać szczegółowe informacje drogą mailową, kontaktując się z dr. Tomasikiem pod adresem bartlomiej.tomasik@gumed.edu.pl.
Materiały prasowe GUMed
























KOMENTARZE