Hodowle komórek roślinnych mają szeroki zakres zastosowań – od badań podstawowych (np. badań nad wzrostem i różnicowaniem roślin) po masową produkcję metabolitów pochodzenia roślinnego (np. produkcję środka przeciwnowotworowego paklitakselu). W związku z tym są one coraz bardziej atrakcyjną i opłacalną alternatywą dla klasycznych podejść do produkcji metabolitów pochodzenia roślinnego na dużą skalę. Kluczowe jest monitorowanie warunków hodowli w celu optymalizacji tempa proliferacji komórek i maksymalizacji poziomów produktywności. Jednocześnie komórki muszą być scharakteryzowane, aby wykryć zmiany, takie jak tworzenie agregatów komórkowych lub liza komórkowa.
Fot. 1. Mikrobioreaktor BioLector XT i analizator Multisizer 4e – narzędzia do monitorowania i optymalizacji hodowli komórek roślinnych
Drożdże to jednokomórkowe grzyby, które mają struktury komórkowe i procesy typowe dla eukariotów (np. organelle, cytoszkielet, jądro komórkowe, systemy sekrecyjne białek czy mechanizmy regulacji transkrypcji i translacji). Ponadto są stosunkowo łatwe i tanie w hodowli w warunkach laboratoryjnych, wykazują szybki wzrost, można je modyfikować genetycznie i są w stanie prowadzić część modyfikacji potranslacyjnych wymaganych dla otrzymywania biologicznie aktywnego białka rekombinowanego. Te cechy sprawiają, że hodowle drożdży są popularnym wyborem do badań podstawowych (np. badania funkcji określonych genów lub białek) i produkcji białek do różnych zastosowań (np. katalizy, paliw, żywności i farmacji).

Fot. 2. Mikrobioreaktor BioLector XT i licznik Coultera Multisizer 4e – narzędzia do optymalizacji i monitorowa nia hodowli drożdży
Monitorowanie wzrostu komórek
Rozmiar jest ważnym parametrem używanym do badań różnych mechanizmów komórkowych (np. cyklu komórkowego, regulacji osmotycznej, śmierci komórki, patogenezy, fagocytozy, różnorodności gatunków itp.). Multisizer 4e wykorzystuje metodę Coultera do wykrywania cząstek od 200 nm do 1600 μm, niezależnie od natury lub właściwości optycznych cząstki. Cząstki zawieszone w 0,9% roztworze elektrolitu są przeciągane przez mały cylindryczny otwór (aperturę). Pomiędzy dwiema zanurzonymi elektrodami umieszczonymi po obu stronach otworu przepływa prąd elektryczny. Gdy pojedyncza cząstka przechodzi przez otwór, swoją objętością zmienia ilość elektrolitu, chwilowo zwiększając impedancję układu. Powoduje to impuls napięcia proporcjonalny do objętości cząstki. Liczba impulsów elektrycznych wskazuje liczbę cząstek, podczas gdy amplituda impulsu elektrycznego zależy od objętości cząstki. Pozwala to badaczom dokładnie określić objętość, liczbę i stężenie komórek w próbce oraz wykrywać zmiany ich wielkości w czasie rzeczywistym. Ten ostatni parametr jest szczególnie przydatny do wykrywania agregatów komórkowych, które zazwyczaj występują w hodowlach komórek roślinnych. W poniższym przykładzie instrument Multisizer 4e został użyty do oceny zakresu rozmiarów komórek w hodowli komórek roślinnych.
Przykład badań
Metody
Próbkę hodowli komórek roślinnych rozcieńczono wstępnie w stosunku 1:200 Isotonem 2 w zlewce o pojemności 400 ml. Z tego roztworu do każdego pomiaru użyto 500 μl. Zastosowano otwór o średnicy 1000 μm, a każdy pomiar trwał 120 sekund. Pełną listę ustawień przedstawiono w tabeli 1. Wygenerowane dane przetworzono przy użyciu techniki Digital Pulse Processing (DPP), która umożliwia pozyskanie, przechowywanie i wyświetlanie każdego pojedynczego impulsu. Oznacza to, że poszczególne obszary widma impulsów można ocenić oddzielnie w późniejszym terminie.
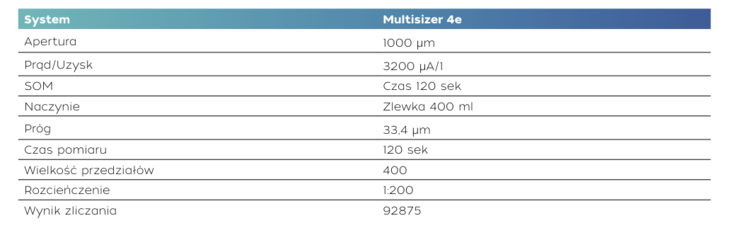
Tab. 1. Ustawienia zastosowane w trakcie badania
Wyniki
Pozyskane w wyniku eksperymentu dane DPP, pokazane na rysunku 1, wskazują, że wielkość komórek roślinnych w tej hodowli mieściła się w zakresie od 30 do 320 μm.
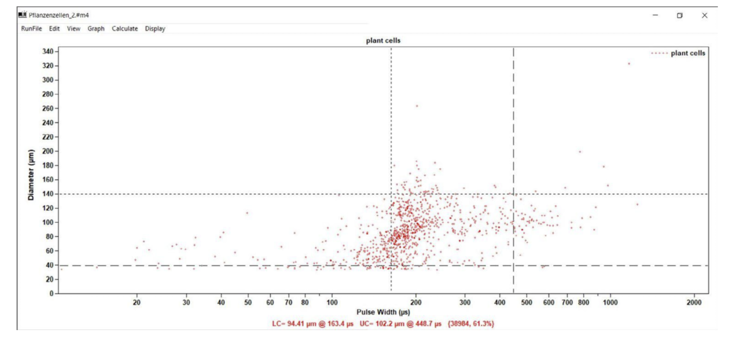
Rys. 1. Dane Digital Pulse Processing. Punkty odzwierciedlają szerokość impulsu w porównaniu z wielkością cząstki. Linie przerywane ograniczają obszar zawierający punkty danych wybrane do dalszej analizy
Z danych można wybrać interesujący nas obszar (linie przerywane na rysunku 1) i utworzyć różne histogramy częstotliwości (tj. liczbę komórek dla każdej objętości), np. rysunek 2 pokazuje histogram po wybraniu zakresu od 40 do 140 μm.
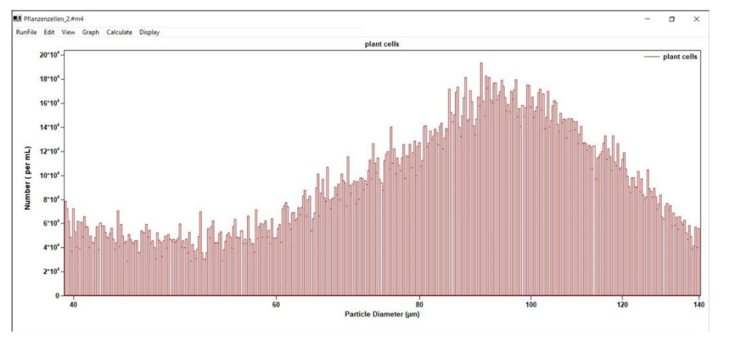
Rys. 2. Rozkład rozmiarów komórek w próbce (średnica w μm)
Wielkość obiektów i ich zmiana w czasie mają szeroki zakres zastosowań, np. ocena zmiany rozmiaru cząstek w czasie może pomóc w charakteryzowaniu formowania agregatów komórkowych. Ponadto porównanie rozmiaru komórek, uzyskanych przy użyciu różnych warunków środowiskowych, może pomóc w optymalizacji warunków hodowli komórkowej. Technika DPP zapewnia wysoką rozdzielczość i dokładność (tj. wykrywanie 1 cząstki w 1 ml próbki), co jest nieosiągalne przy użyciu innych technik.
Monitorowanie optymalnych warunków hodowli komórkowej
Mikrobioreaktor BioLector to zautomatyzowany, operujący w małej skali system, który umożliwia badania przesiewowe o wysokiej przepustowości, monitorowanie parametrów hodowli (np. pH, biomasy, nasycenia tlenem, szybkości wytrząsania i intensywności fluorescencji) oraz optymalizację strategii odżywiania. Co ważne, wszystkie te parametry są monitorowane online bez konieczności zatrzymywania wytrząsania lub pobierania próbek. W tym przykładzie urządzenie BioLector zostało użyte do określenia optymalnego zakresu pH dla wydajnej produkcji białka w modelu drożdżowym Hansenula polymorpha.
Metody
Hodowle H. polymorpha ekspresujące białko o zielonej fluorescencji (GFP) prowadzono w mikroprzepływowej 32-dołkowej płytce mikrotitracyjnej FlowerPlate mikrobioreaktora BioLector z optodami odpowiednimi dla niskiego zakresu pH (M2P-MTP-MF32-BOH3). Płytkę wytrząsano z prędkością 1200 obr./min, w temperaturze ustalonej na 30°C. Podłoże hodowlane składało się z 1,34 g/l Yeast Nitrogen Base, 5 g/l (NH4)2SO4 oraz 20 g/l glukozy. Każdy dołek hodowlany wypełniono 800 μl bulionu hodowlanego. Użyto 25 mM buforu fosforanowego (pH 6,0). Do uzyskania różnych wartości pH pomiędzy 4 a 6,5 posłużono się chipem mikroprzepływowym. Jako odczynniki regulujące wartość pH zastosowano 3M NaOH i 3M HCl. Podczas hodowli wykonywano pomiary online fluorescencji białka GFP i pH. pH mierzono optycznie w widmie podczerwieni, aby zmniejszyć interferencję z fluorescencją tła w podłożu hodowlanym. Sygnał GFP był używany jako wskaźnik syntezy białek drożdży.
Wyniki
Sygnał GFP i wartości pH trzech przykładowych hodowli pokazano na rysunku 3. Wyniki wykazały, że im niższe pH, tym wcześniej rozpoczyna się ekspresja GFP. Ponadto tempo produkcji GFP było również wyższe, gdy wartość pH ustalono na 4.
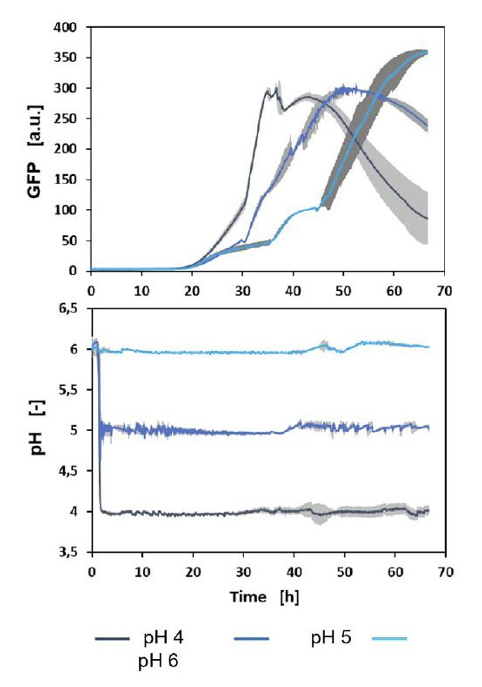
Rys. 3. Mikroprzepływowa hodowla wsadowa H. polymorpha z pomiarem GFP i regulacją/pomiarem pH online
Zgodnie jednak z wcześniejszymi doniesieniami GFP nie jest stabilne w niższym zakresie pH 4 i z tego powodu w tym przypadku możliwe jest jedynie porównanie jakościowe. W dalszej kolejności obliczenie wydajności objętościowo-czasowej (STY) ekspresji GFP dla każdej wartości pH potwierdziło, że większa ilość GFP pojawiła się przy niskich wartościach pH (rysunek 4).
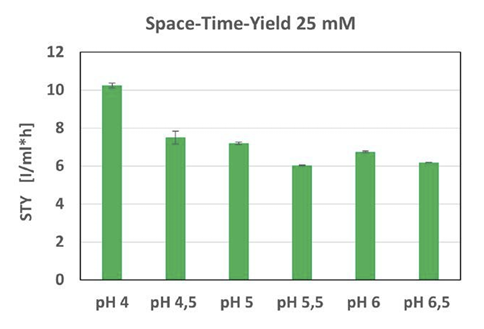
Rys. 4. Obliczanie wydajności objętościowo-czasowej (STY) GFP osiągniętej w uprawach H. polymorpha przy różnych wartościach pH
Wykorzystując opcję mikroprzepływu BioLector możliwe było jednoczesne przeprowadzenie do 32 równoległych eksperymentów hodowlanych przy różnych wartościach pH na jednej MTP (płytce do mikromiareczkowania). Niniejsza nota aplikacyjna pokazuje, że system BioLector może być używany do badań przesiewowych najlepszych warunków pH dla optymalnej ekspresji białka w H. polymorpha. Podobnie instrument może być używany do optymalizacji innych parametrów hodowli (np. stężenia buforu fosforanowego w podłożu, temperatury, stężenia tlenu, substratów węglowych itp.).
Poprzednie badania wykazały skuteczność mikrobioreaktora BioLector w określaniu optymalnych warunków hodowli oraz modyfikowaniu szczepów drożdży przed rozpoczęciem produkcji na większą skalę. Podsumowując, system umożliwia ocenę i rozróżnianie różnych hodowli, a tym samym – poprawia warunki badań przesiewowych, rozwój procesu i procedury skalowania.
Wnioski
Mikrobioreaktor BioLector XT i analizator Multisizer 4e to wszechstronne, stacjonarne urządzenia z intuicyjnym interfejsem użytkownika, które można zintegrować z dowolnym laboratorium w celu optymalizacji i monitorowania hodowli komórek roślinnych i drożdży. Sprawdzona wydajność urządzeń w monitorowaniu hodowli komórek roślinnych i drożdży sprawia, że są one przydatne zarówno z naukowego punktu widzenia, jak i w optymalizacji produkcji przemysłowej. Urządzenia te nie tylko dostarczają danych w czasie rzeczywistym, ale także umożliwiają precyzyjną optymalizację warunków wzrostu, co czyni je bardzo użytecznymi narzędziami do rozwoju badań i doskonalenia procesów w szerokim zakresie zastosowań.
Autorka: Ph.D. Mariana Gil



























KOMENTARZE