W procesie wczesnych faz rozwoju cząsteczek terapeutycznych niezwykle istotne są badania ich skuteczności, ale także potencjalnej toksyczności. Takie badania zaczyna się od zastosowania prostych modeli in vitro – czyli hodowli komórkowych 2D (hodowli monowarstwowych), w których wykorzystuje się linie komórkowe pochodzące z różnych nowotworów, tak dobrane, aby odpowiadały wybranemu wskazaniu terapeutycznemu, wykorzystując również, w miarę możliwości, linie komórek kontrolnych. Ten pierwszy etap badań pozwala wstępnie określić, czy dana cząsteczka wykazuje skuteczną aktywność przeciwnowotworową, ograniczając np. proliferację komórek nowotworowych, ich inwazyjność czy indukując w nich apoptozę (śmierć komórek), pozostając tym samym obojętna względem komórek prawidłowych. Od kilku lat niezwykłą popularnością cieszy się wykorzystanie hodowli komórkowych 3D (nazywanych organoidami). Struktury tego typu są często tworzone spontanicznie przez komórki nowotworowe w odpowiednim środowisku zewnątrzkomórkowym (rozumianym jako właściwie dobrane macierze komórkowe, takie jak np. Matrigel, kolagen, kwas hialuronowy, itd.) lub też w warunkach współhodowli z innymi komórkami, takimi jak fibroblasty związane z nowotworem (CAF, z ang. cancer associated fibroblasts) czy niektóre komórki o charakterze komórek macierzystych (CSC, z ang. cancer stem cells). Struktury organoidów dużo bardziej odpowiadają morfologicznie strukturze guza nowotworowego i pozwalają na przebadanie wielu procesów związanych z nowotworzeniem, np. procesów sygnalizacji międzykomórkowej i wewnątrzkomórkowej prowadzących do powstania guza, inicjacji waskularyzacji, hipoksji (inaczej niedotlenienia) czy ewentualnej penetracji aktywnej cząsteczki terapeutycznej. Dodatkowo w hodowlach in vitro 2D i 3D możemy przebadać efektywność cząsteczek terapeutycznych opartych np. na przeciwciałach (używanych w tzw. terapiach celowanych), wykorzystując tym samym ludzkie komórki immunologiczne jako komórki efektorowe. Niestety, złożoność procesu nowotworzenia uwzględniająca tworzenie się specyficznego mikrośrodowiska guza (TME, z ang. tumor microenvironment) zawierającego oprócz komórek nowotworowych wiele klas komórek immunologicznych, komórek zrębowych (podścielisko nowotworu) i innych komórek wraz ze złożoną siecią komunikacji bezpośredniej i chemotaktycznej (cytokiny, chemokiny) powoduje, że dogłębna analiza tych procesów w warunkach in vitro jest bardzo ograniczona. Stąd rodzi się konieczność wykorzystania modeli zwierzęcych, w których możliwości analizy procesów nowotworowych in vivo są bardziej zaawansowane.
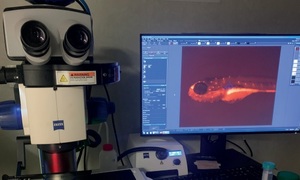
Mając na uwadze, że wykorzystanie zwierząt do doświadczeń budzi sprzeciw natury etycznej, dąży się do zmniejszenia wykorzystywania zwierząt wyższych w badaniach naukowych i przedklinicznych, stosując tym samym zasadę „3R” (z ang. replace, reduce, refine), czyli zastąpienia zwierząt innymi modelami, redukowania ilości zwierząt wykorzystywanych w doświadczeniu oraz udoskonalania procedur doświadczalnych z wykorzystaniem zwierząt tak, aby zminimalizować ich dotkliwość, a tym samym – ograniczyć ból, cierpienie i dystres zwierząt. Dobrym przejściem z badań in vitro w kierunku badań in vivo jest wykorzystanie prostych modeli zwierzęcych, takich jak larwy ryb danio pręgowanego (Danio rerio), co budzi mniejszy sprzeciw moralny. Istotnym jest, że od 24 godzin po zapłodnieniu (hpf, z ang. hours post fertilization) larwy ryb danio mają wykształcone większość narządów odpowiadających organom ludzkim, w tym układ krwionośny z bijącym sercem. Z prawnego punktu widzenia badania na larwach do 120 hpf nie wymagają zgody Lokalnej Komisji Etycznej. W ostatnich 20 latach model ten zyskał olbrzymią popularność w badaniach onkologicznych poprzez możliwość wszczepiania u ryb danio ksenotransplantów (z ang. xenografts) nowotworowych i badanie procesów nowotworzenia, takich jak proliferacja, przerzutowanie czy waskularyzacja. Na wczesnym etapie życia larwy danio pręgowanego nie posiadają w pełni funkcjonalnego układu odpornościowego, w związku z tym nie dochodzi u nich do odrzutu ksenotransplantów. Należy również wspomnieć, że duże podobieństwo genetyczne (ok. 70%) pomiędzy rybami danio i ludźmi powoduje, że mutacje w obrębie niektórych onkogenów powodują rozwój choroby nowotworowej w identyczny sposób, jak u ludzi (np. mutacje w genach BRAF czy NRAS prowadzą do rozwoju czerniaka u ryb danio). W literaturze naukowej pojawiają się coraz częściej doniesienia o skutecznym wykorzystaniu larw danio pręgowanego w medycynie spersonalizowanej, gdzie przetestowano dziesiątki kombinacji leków na ksenotransplantach nowotworu pobranego od pacjenta (PDX, z ang. patient-derived xenografts) w celu znalezienia najbardziej optymalnej i efektywnej kombinacji, którą potem zastosowano u danej osoby chorej. Istnieje również wiele modeli genetycznych ryb danio, takich jak np. ryby z wyznakowanym fluorescencyjnie układem krwionośnym, w którym można śledzić przemieszczające się komórki nowotworowe czy badać procesy waskularyzacji guza nowotworowego. Innym interesującym modelem do badań onkologicznych są ryby z obniżoną odpornością (SCID, z ang. severe combined immunodeficiency), szczególnie przydatne w badaniach immunoonkologicznych prowadzonych na dorosłych rybach, do których oprócz ksenotransplantów PDX możemy wprowadzić ludzkie komórki immunologiczne jako komórki efektorowe i w pewnym sensie stworzyć zhumanizowany model choroby nowotworowej, w którym można testować potencjalne leki onkologiczne. Wraz z rozwojem modelu badawczego ryb danio idzie rozwój technologiczny umożliwiający coraz bardziej szczegółowe i precyzyjne badania. Na rynku istnieją systemy mikroskopowe, takie jak lightsheet microscopy umożliwiające dokładną wizualizację struktur (organów, transplantów, komórek, organelli komórkowych) wybarwionych fluorescencyjnie w żywych rybach. Są dostępne systemy do badań wysokoprzepustowych z możliwością wizualizacji np. ksenotransplantów i analizy ich rozwoju w czasie kilku dni (np. w badaniach cząsteczek aktywnych przeciwnowotworowo), przy jednoczesnym monitoringu funkcji życiowych larw ryb. Należy również wspomnieć, że w pracowni obrazowania rezonansu magnetycznego (MRI, z ang. magnetic resonance imaging) Ośrodka Medycyny Doświadczalnej w Lublinie od stycznia 2024 r. będzie działał drugi w Europie system wykorzystujący czterokanałowe kriocewki i umożliwiający badania MRI w polu magnetycznym 7T (7 tesli) właśnie na rybach danio.
Oczywiście badania na rybach danio mają pewne ograniczenia, choćby natury fizjologicznej i anatomicznej, ponieważ ryby są organizmami wodnymi, więc nie posiadają płuc, a ich system wydalniczy działa inaczej. Z drugiej strony ułatwia to testowanie potencjalnych cząsteczek terapeutycznych, które mogą być rozpuszczone w wodzie i penetrować do organizmu ryby, a tym samym – wszczepionych komórek nowotworowych. Wydaje się więc, że ryby danio mogą być idealnym „pomostem” w badaniach onkologicznych łączącym wstępne badania in vitro i bardziej zaawansowane badania in vivo z wykorzystaniem modeli zwierzęcych, takich jak gryzonie, przyczyniając się jednocześnie do znaczącego zmniejszenia wykorzystania tych ostatnich, gdyż wiele problemów badawczych może zostać rozwiązanych używając właśnie ryb.
Autor: Dr Tomasz Trombik, biochemik i biofizyk, od 2022 r. kierownik Ośrodka Medycyny Doświadczalnej Uniwersytetu Medycznego w Lublinie. Od wielu lat zajmuje się badaniami błony komórkowej i białek błonowych związanych z metabolizmem cholesterolu, a ostatnio ich związkiem z procesami nowotworzenia. Przez kilka lat pracował również nad rozwojem terapeutycznych przeciwciał monoklonalnych jako kierownik Laboratorium Biochemii Przeciwciał Terapeutycznych w MI-mAbs we Francji oraz wicedyrektor ds. Badań Przedklinicznych w Pure Biologics S.A. we Wrocławiu.























KOMENTARZE