Fot. Model glejaka stworzony przy użyciu biodrukarki 3D, źródło: University of Twente
Zespół badawczy zrzeszający naukowców z trzech kontynentów udowadnia, że dzięki włączaniu biodruku 3D do doświadczeń skupiających się na nowotworach zbliżamy się ku lepszemu poznaniu ich natury i fizjologii. Naukowcy stworzyli niezwykle dokładny model glejaka wielopostaciowego, którego poddali działaniu mikrograwitacji, aby dowieść, że stan nieważkości powstrzymuje rozwój nowotworów. Potwierdzenie szkodliwości braku grawitacji na tworzenie i rozprzestrzenianie się guzów mózgu otwiera nowe możliwości na opracowanie skutecznej terapii antynowotworowej. Więcej informacji o tym niesamowitym eksperymencie uzyskasz w poniższym artykule.
Zasada działania biodruku
Potencjał biodruku 3D leży w przeniesieniu analiz z poziomu hodowli komórkowych 2D do badań na strukturach przypominających fizjologicznie i funkcjonalnie żywe tkanki oraz narządy. Technologia ta opiera się na tradycyjnym druku 3D, a zatem na tworzeniu przestrzennych konstruktów warstwa po warstwie z użyciem różnych technik. Cechą odróżniającą te dwie technologie jest rodzaj materiału używanego do druku. W klasycznym druku 3D stosuje się różnego rodzaju polimerowe filamenty, proszki czy żywice, natomiast w biodruku używane są głównie biotusze – hydrożele zawierające najczęściej żywe komórki zawieszone w macierzy stanowiącej dla nich podporę oraz naśladującej środowisko zewnętrzne komórek. Założeniem biodruku jest indukcja wytwarzania macierzy zewnątrzkomórkowej przez komórki po wydruku w celu ich funkcjonalizacji i utworzenia przez nie właściwych tkanek i narządów.
Techniki biodruku 3D
Techniki stosowane głównie w biodruku 3D można sklasyfikować jako: ekstruzyjne, laserowe oraz inkjetowe. Technika ekstruzyjna polega na wyciskaniu hydrożelu z kartridża. Cechuje się średnią rozdzielczością druku oraz wysokimi naprężeniami ścinającymi, oddziałującymi negatywnie na komórki, ale za to wysoką integralnością wydrukowanej struktury oraz krótkim czasem fabrykacji, przez co stała się najbardziej uniwersalną techniką biodruku. Umożliwia tworzenie zarówno prostych, jak i skomplikowanych modeli trójwymiarowych. Inną techniką jest inkjet polegający na wystrzeliwaniu z głowicy pojedynczych kropli nośnika zawierającego komórki. Na drodze termicznej, akustycznej lub przy użyciu kryształów piezoelektrycznych w kartridżu powstaje bąbel wypychający kroplę z dyszy, co umożliwia bezkontaktowy druk kształtów układanych z pojedynczych kropli. Wiąże się to z możliwością użycia materiałów wyłącznie o niskiej lepkości, za to dużą zaletą tej metody jest wysoka żywotność komórek mierzona po druku. Technika laserowa jest również jedną z podstawowych metod biodruku. Laser może odpowiadać za fotopolimeryzację lub transfer komórek. Jest to technika pozwalająca na osiąganie wysokiej rozdzielczości i precyzji wydruku oraz stosowanie tuszów o wysokiej lepkości. Jednakże podczas stosowania tej techniki komórki narażone są na szkodliwe działanie światła oraz wysokich temperatur pochodzących od lasera, skutkując ich niższą żywotnością oraz zdolnością do agregowania.
Jak działa biodrukarka?
Biodrukarka 3D jest urządzeniem, które w oparciu o jedną lub wiele technik druku jednocześnie tworzy zaprojektowane przez użytkownika kształty warstwa po warstwie przy użyciu biotuszu. To, co odróżnia znacząco biodrukarkę od zwykłej drukarki 3D, jest zapewniona sterylność środowiska wydruku oraz uniwersalność druku – umożliwia to użycie różnych biotuszy i typów komórek z każdym kolejnym wydrukiem. Dodatkowo biodrukarka może posiadać funkcję kontroli temperatury głowicy oraz stołu, a także poziomu wilgotności. Podstawowymi elementami budującymi biodrukarkę ekstruzyjną (jako tę najbardziej uniwersalną) są głowica, z której wyprowadzany jest biotusz oraz stół roboczy, na którym tworzone są konstrukty w osiach X, Y oraz Z. Nowsze modele mają wbudowane kilka głowic, które mogą drukować kilkoma rodzajami biotuszy jednocześnie. Na biotusze składa się szeroka gama hydrożeli pozyskiwanych z naturalnych i sztucznych polimerów, takich jak: alginian, kolagen, chitosan czy fibryna lub glikol polietylenowy, które łączą się z komórkami przed wydrukiem. Hydrożele są sieciowane (żelowane) optycznie w zakresie UV-VIS lub chemicznie w celu utrzymania odpowiedniego kształtu po wydruku. Można również drukować agregatami komórek – sferoidami lub organoidami.
Nowy lepszy model badawczy
Technologia biodruku 3D jest stosowana w połączeniu z innymi technologiami z zakresu medycyny i biotechnologii z dużym powodzeniem. Przykładem tego jest projekt zespołu Giulii Silvani będący kombinacją biodruku oraz układu mikroprzepływowego. Autorzy przytaczanej we wstępie publikacji zmierzyli się z problemem utrudnionego leczenia glejaka wielopostaciowego (ang. GBM). Na biodostępność chemioterapeutyków podawanych pacjentom podczas leczenia tego nowotworu składa się kilka czynników, takich jak integralność i przepuszczalność naczyń krwionośnych tworzących barierę krew-mózg (ang. BBB) oraz dynamiczna migracja komórek glejaka do otaczającego go mikrośrodowiska. Niestety dotychczasowe modele in vitro okazały się niewystarczające do odtworzenia warunków in vivo, czyniąc glejaka chorobą o praktycznie 100% śmiertelności, z niską skutecznością lekoterapii.
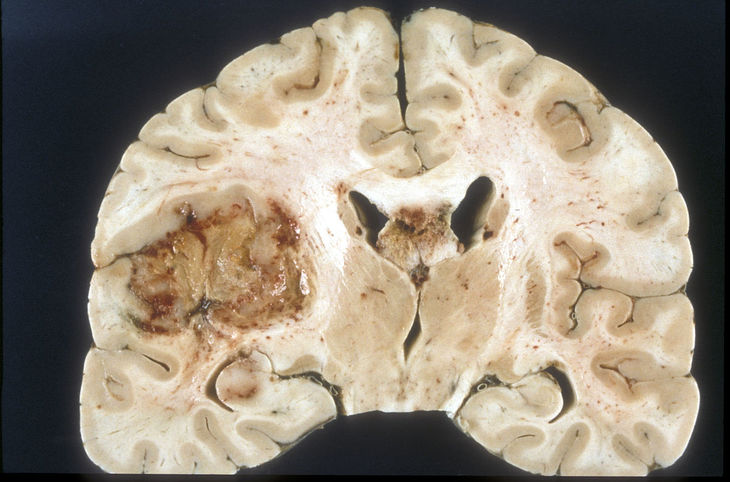
Fot. Glejak wielopostaciowy, źródło: Sbrandner, Wikimedia.org
Mózg drukowany na szkle? Tak, to możliwe!
Naukowcy stworzyli model GBM na chipie mikrofluidycznym (organ-on-chip), próbując przy tym jak najwierniej odwzorować mikrośrodowisko systemu naczyń krwionośnych mózgu pod względem mechanicznym i chemicznym. Zastosowali również biodruk 3D, uzyskując przy tym złożoną przestrzenną strukturę guza. Połączenie obu tych technologii umożliwiło badaczom kontrolę nad siłami hydrodynamicznymi, lokalnymi właściwościami mechanicznymi oraz uzyskanie auto-organizacji komórek w fizjologiczną architekturę nowotworu. Chip odlany z PDMS’u zawierał trzy indywidualne przedziały: tkankowy (czerwony), naczyniowy (zielony) otaczający przedział tkankowy oraz dwa niezależne kanały mikroprzepływowe (szare) zlokalizowane po obu stronach chipu.
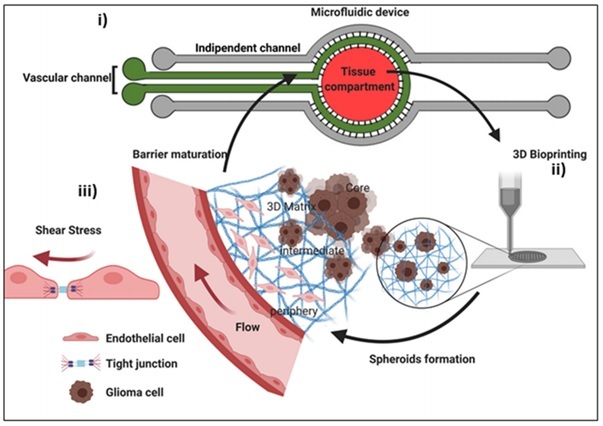
Fot. Model guza na chipie mikrofluidycznym, źródło: Wiley Online Library
i) schemat urządzenia mikroprzepływowego;
ii) procedura biodruku zrębu guza glejaka wielopostaciowego;
iii) schemat wyglądu połączeń ścisłych między komórkami śródbłonka naczyń krwionośnych.
Guz składający się z wysoko skoncentrowanych komórek glejaka wielopostaciowego oraz otaczających komórek śródbłonka mózgu został nadrukowany bezpośrednio na chip. Aby odwzorować strukturę zrębu glejaka, użyto mieszanki biotuszy GelMA (metakrylan żelatyny) z alginianem oraz GelMA z fibryną w celu utrzymania tkankowo specyficznej funkcjonalności komórek endotelialnych. Tusz GelMA-fibryna połączony z komórkami endotelialnymi hCMEC/D3 został użyty do wydruku pierścienia otaczającego rdzeń guza, a następnie użyto tuszu GelMA-alginian z komórkami glejaka wielopostaciowego do druku rdzenia guza. Po 24 godzinach inkubacji badanie mikroskopowe dzięki zastosowanym barwnikom fluorescencyjnym wykazało, że komórki zaczęły tworzyć sferoidy wokół rdzenia (co jest jak najbardziej normalnym zjawiskiem w przypadku glejaka) i utrzymały swoją żywotność po 72 godzinach. Dodatkowo wykazano, że w każdej dobie zwiększała się liczba sferoidów oraz ich wymiary, co potwierdzało potencjał stworzonego modelu glejaka.
Odtworzenie fizjologicznej bariery krew-mózg w warunkach in vitro
W przedziale naczyniowym uprzednio funkcjonalizowanym fibronektyną zasiano komórki endotelialne dwóch linii – HUVEC oraz hCMEC/D3, aby stworzyć barierę biologiczną odwzorowującą fizjologicznie barierę krew-mózg. Po 72 godzinach hodowli z perfuzją medium hodowlanego w celu zadania fizjologicznych naprężeń ścinających komórki obu linii utworzyły na ścianach kanału monowarstwę. Dodatkowo potwierdzono, że komórki wytworzyły białko ZO-1 odpowiedzialne za formację połączeń ścisłych, a także wykazano przekształcenie filamentów aktynowych w filamenty korowe (cortical filaments), co dowiodło utworzenie bariery biologicznej. W celu zbadania jej przepuszczalności wprowadzono czerwień teksańską (barwnik fluorescencyjny) do kanału naczyniowego. Dekstran, cechujący się dużym ciężarem cząsteczkowym (40 kDa), naśladował makrocząsteczkę, która nie powinna przedostać się przez barierę. Za pomocą mikroskopii fluorescencyjnej wykazano, że komórki linii hCMEC/D3 utworzyły bardziej szczelną barierę niż komórki HUVEC.
Punkt zwrotny w badaniach nad nowotworami
Wcześniejsze badania wykazały, że komórki nowotworowe znajdujące się w stanie braku pola grawitacyjnego mają ograniczoną zdolność agregacji i rozprzestrzeniania się w otaczającym je mikrośrodowisku. Aby dowieść wpływu mikrograwitacji (µG) na tworzenie się guzów glejaka, wydrukowany konstrukt guza umieszczono w maszynie RPM (Random Positioning Machine) oraz inkubowano w warunkach zmiennej orientacji, naśladując warunki stanu nieważkości. Dzięki temu zabiegowi naukowcy dowiedli, że warunki µG sprawiły, iż komórki glejaka pozostały równomiernie rozłożone w rdzeniu guza oraz nie rozprzestrzeniły się poza jego obszar i choć pozostały żywe, to ich zdolność do agregacji została ograniczona. Udowodniono zatem, że formowanie się sferoidów glejaka wielopostaciowego jest zależne od grawitacji, a jej brak zaburza podstawowe mechanizmy tych komórek.

Fot. Homogeniczna dystrybucja komórek modelu glejaka wielopostaciowego poddanego działaniu mikrograwitacji, źródło: Wiley Online Library
Nowotwór w kosmosie nie ma szans
Wykazano również ograniczoną proliferację komórek GBM oraz hCMED/D3 w warunkach braku grawitacji. Badania powierzchni i kształtu komórek GBM oraz obu linii endotelialnych dowiodły, że regulacja morfologii komórek także zależy od grawitacji, a zatem potwierdzono wpływ mikrograwitacji na fenotyp guza glejaka wielopostaciowego. Ponadto wykonano analizę ekspresji białek komórek GBM oraz hCMEC/D3 poddanych działaniu µG przy użyciu metody western blot. Wyniki pokazały, że zarówno w przypadku obu typów komórek doszło do obniżenia ekspresji winkuliny odpowiedzialnej za migrację i adhezję, jak i białka Yap1 działającego jako regulator transkrypcji oraz białko sygnałowe. W przypadku komórek linii endotelialnej doszło także do obniżenia poziomu białka ZO-1 tworzącego połączenia ścisłe między komórkami, co potwierdziło tezę głoszącą szkodliwe działanie braku grawitacji na integralność naczyń krwionośnych.
Perspektywy na przyszłość badań nad glejakiem
Powyższe wyniki pokazują, że zespół Guilii Silvani opracował model nowotworu, który jest niezwykle zbliżony do glejaka in vivo, do czego niezbędna okazała się technologia biodruku 3D. To badanie daje nadzieję na lepsze i bardziej precyzyjne opracowanie terapii antynowotworowej oraz pokazuje, jak wielki potencjał mają doświadczenia opierające się na biodruku. Popularyzacja biodruku oraz jego szerokich możliwości przyczynia się do dynamicznego rozwoju nauki, tworzenia nowatorskich rozwiązań, a także ograniczenia użycia modeli zwierzęcych w doświadczeniach, co ze względów etycznych jest ogromnym postępem. Już teraz wykorzystywany jest nie tylko w doświadczeniach, ale też w odtwarzaniu uszkodzonych elementów ciała ludzkiego (np. rogówki), co drastycznie poprawia komfort życia pacjentów. W przyszłości prawdopodobnie technologia ta pozwoli na drukowanie całych tkanek oraz funkcjonalnych narządów przy użyciu komórek pacjenta, co umożliwi udoskonalenie transplantologii oraz opracowanie wielu nowych spersonalizowanych terapii.
Autor: Aysia Khan, Sygnis Bio Technologies
























KOMENTARZE