Fot. Prof. Marcin Poręba, źródło: PWr
Biomarkery nowotworowe (inaczej znaczniki nowotworowe) są substancjami, takimi jak białka, hormony, enzymy czy małocząsteczkowe związki chemiczne, których stężenie u pacjenta z nowotworem złośliwym znacznie przekracza normy występowania u zdrowego człowieka. Można je badać z krwi, moczu lub wycinków tkanek. Takie substancje wytwarzają zarówno komórki nowotworowe, jak i te zdrowe, które reagują na rozwijającą się w ciele człowieka chorobę. Większość takich biomarkerów zostało odkrytych poprzez analizę genomu, czyli zbioru całej informacji genetycznej, jaką zawiera komórka, a także proteomu, a więc zestawu białek występujących w komórce, oraz metabolomu. Ten ostatni to zestaw wszystkich metabolitów obecnych w komórce, czyli np. aminokwasów czy lipidów. – Ten obraz nie jest jednak kompletny. Uważamy, że brakującym elementem tego systemu jest aktywom, czyli zestaw katalitycznie aktywnych białek – podkreśla dr hab. inż. Marcin Poręba, prof. PWr z Katedry Chemii Biologicznej i Bioobrazowania na Wydziale Chemicznym.
Prof. Poręba tłumaczy, że proteomika pozwala nam określić, ile enzymów nowotworowych występuje w próbce pobranej od badanego pacjenta. Nic jednak nie mówi nam o tym, jak bardzo są one aktywne. Może więc okazać się, że wynik pokazujący duże stężenie takich enzymów wcale nie świadczy o trwającej chorobie. Wystarczy, że enzym jest jeszcze w tzw. proformie, czyli nie uzyskał aktywności katalitycznej, albo w sytuacji odwrotnej – już jej nie ma, bo został zdegradowany. Przez aktywność katalityczną rozumiemy zdolność enzymu do katalizowania pewnej reakcji chemicznej, np. hydrolizy (przecinania) wiązań peptydowych charakteryzujących enzymy proteolityczne (proteazy) czy zdolności do fosforylowania białek charakteryzujących kinazy białkowe. W ten sposób enzymy te kontrolują syntezę, aktywację i degradację białek, przez co uczestniczą w każdym procesie komórkowym.
Jedyne takie urządzenie w Polsce
Prof. Poręba razem ze współpracownikami zamierza więc stworzyć nową metodę analizy pojedynczych komórek nowotworowych właśnie w kontekście aktywności poszczególnych proteaz (enzymów proteolitycznych). Posłuży się cytometrem masowym – najnowocześniejszym obecnie urządzeniem do analizy i diagnostyki próbek komórkowych i zaawansowanej proteomiki. W całej Polsce jest tylko jedna taka aparatura – właśnie na Politechnice Wrocławskiej. To także jeden z zaledwie trzech cytometrów w całej Europie Środkowej. Uczelnia kupiła go w 2018 r. Urządzenie to wykorzystuje spektrometrię masową połączoną z cytometrią przepływową, czyli bada próbki przy pomocy analizy widma mas atomów metali, które używane są w tej metodzie jako znaczniki.

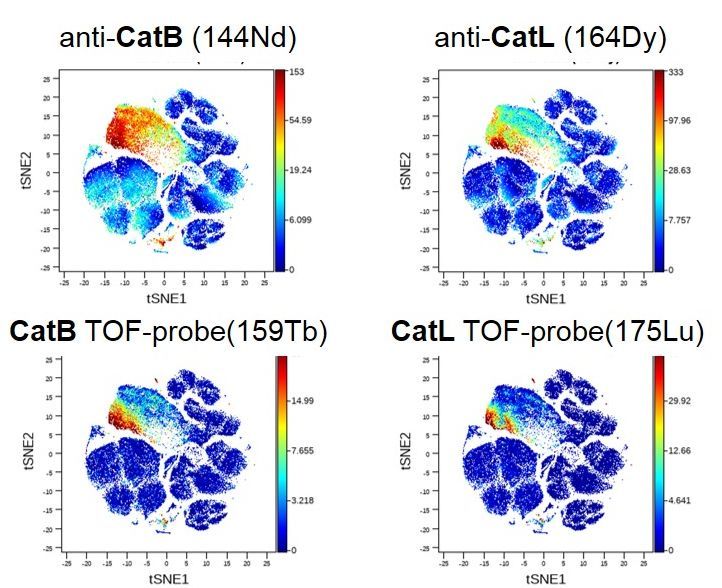
Obecnie do badania proteaz wykorzystuje się markery chemiczne wyposażone w znaczniki fluorescencyjne. W takich analizach jeden kolor odpowiada jednemu enzymowi, dla którego taki marker został stworzony. Nie jest to jednak metoda idealna – ze względu na nakładanie się widm emisji przy większej liczbie barw. Naukowcy z PWr chcą więc wprowadzić markery chemiczne zawierające metale – a konkretnie stabilny izotop metalu przejściowego (nazywa się je TOF – z ang. TOF-probe, Time-Of-Flight). Są one kompatybilne z cytometrią masową i zostały niedawno opracowane przez wrocławskich naukowców. – Stabilny izotop w tych markerach ma ściśle zdefiniowaną masę cząsteczkową. Nie powoduje więc promieniowania i dlatego jest bezpieczny dla człowieka. Doskonałość cytometrii masowej polega na tym, że każdy izotop metalu ma swój własny pik na widmie masowym, a to eliminuje problem nakładania się sygnałów i do tego pozwala na jednoczesne monitorowanie ponad 50 parametrów na poziomie pojedynczych komórek. Zazwyczaj w analizach wykorzystuje się przeciwciała połączone z polimerami zawierającymi metale. W odróżnieniu od przeciwciał nasze markery TOF pozwolą na wykrywanie tylko aktywnych enzymów, a dzięki temu będziemy w stanie stworzyć bardzo szczegółowy obraz komórek nowotworowych w kontekście aktywności enzymów proteolitycznych oraz kinaz białkowych – mówi lider projektu.
Cząsteczki, które zniszczą tylko komórki nowotworowe
Badania prof. Poręby są możliwe dzięki 2,5-milionowemu grantowi z Narodowego Centrum Nauki w ramach programu Opus + Lap. Potrwają aż cztery lata (początek w styczniu 2022 r.) i zostały podzielone na trzy etapy. Najpierw naukowcy stworzą markery chemiczne wyposażone w metale dla konkretnych enzymów – proteaz oraz kinaz białkowych – czyli dwóch głównych grup enzymów, które w zależności od sytuacji (biologicznego kontekstu) pełnią w komórce rolę pro- lub antynowotworową. Kluczowe będzie przygotowanie tych markerów dla jak największej grupy proteaz i kinaz. – Później wykorzystamy je w różnych układach biologicznych, czyli na komórkach nowotworowych pobranych od pacjentek z nowotworami piersi. Dzięki cytometrii masowej poznamy rozkład aktywności tych enzymów i zestawimy te informacje z obrazem klinicznym choroby, czyli szczegółowymi informacjami od lekarzy, np. na temat branych przez nich pod uwagę markerów czy możliwości terapii hormonalnej. Tak opracujemy swoisty „odcisk palca komórek nowotworowych”, a to pozwoli nam przejść do kolejnego etapu naszego projektu – opowiada prof. Poręba.
Będzie nim opracowanie koniugatów przeciwciało-lek, które będą aktywowały się tylko przy wybranych enzymach. W ten sposób powstanie rozwiązanie, które pozwoli dostarczyć i aktywować lek w komórkach nowotworowych. – Koniugaty przeciwciało-lek są obecnie jednym z najszybciej rozwijających się segmentów onkologii, ale zdecydowana większość z tych, która dotarła do badań klinicznych, wykazywała znaczną toksyczność i w efekcie nie została dopuszczona do obrotu. W naszym projekcie zamierzamy opracować nową generację bardzo selektywnych koniugatów przeciwciało-lek, które będą aktywowane wyłącznie przez proteazy związane z nowotworem. Mówiąc prościej, przeciwciało rozpozna tylko białka, które są na powierzchni komórki nowotworowej, koniugat dotrze do niej, uwolni lek i zniszczy wyłącznie ją. Dlatego ich ogólnoustrojowa toksyczność zostanie znacznie ograniczona – zaznacza prof. Poręba.
By to osiągnąć, badacze muszą stworzyć bardzo selektywny „linker”, czyli łącznik peptydowy, który zwiąże przeciwciało z lekiem. I tutaj przyda im się szczegółowa wiedza na temat aktywności enzymów w komórkach nowotworowych. Chcą bowiem stworzyć taki łącznik, który na pewno zostanie rozpoznany przez proteazy o podwyższonej aktywności. Główną funkcją tych enzymów jest przecinanie wiązań peptydowych w komórce. Kiedy więc przetną taki „linker” w koniugacie przeciwciało-lek, uwolnią lek, a ten zabije komórkę nowotworową. – Jeśli taki prolek dotrze do zdrowej komórki, nie będzie w niej enzymu, który mógłby przeciąć ten „linker”, a tym samym wypuścić lek. Taka komórka będzie więc bezpieczna – wyjaśnia kierownik projektu.
Badania na myszach
Trzecim etapem badań zajmą się naukowcy ze Słowenii, którzy są partnerami w tym projekcie i dostali grant ze słoweńskiej agencji naukowej (prawie 1,5 mln zł). Analizy poprowadzi zespół prof. Borisa Turka, kierownika Katedry Biotechnologii, Biochemii i Biologii Molekularnej z Instytutu Jožefa Stefana w Lubljanie. Będzie on odpowiedzialny za wszczepianie nowotworów do myszy i obserwowanie rozwoju choroby poprzez zastosowanie markerów typu TOF oraz rezonansu magnetycznego. – Chcemy w ten sposób monitorować efektywność terapeutyczną koniugatów przeciwciało-lek, które opracujemy. Nasze markery zawierają metale, a zatem idealnie nadadzą się do wizualizacji nowotworu w badaniach rezonansem – precyzuje prof. Poręba.
Naukowiec z Wydziału Chemicznego PWr zapewnia, że bardziej szczegółowa analiza biomarkerów nowotworowych, która pozwoli lepiej zrozumieć ich rolę w tej chorobie, jest kluczowa dla walki z rakiem. Badania w tej dziedzinie są tym istotniejsze, że liczba zachorowań na nowotwory złośliwe rośnie z każdą dekadą. Według danych WHO obecnie najbardziej powszechnym nowotworem na świecie jest rak piersi. Szacuje się, że globalnie co roku tę chorobę rozpoznaje się u 1,7 mln kobiet. Proces powrotu do zdrowia po chorobie nowotworowej zależy od kilku czynników – m.in. wczesnej diagnozy, dokładnej klasyfikacji nowotworu czy wyboru spersonalizowanego leczenia. Większa wiedza na temat biomarkerów nowotworowych może w tym pomóc.
Autorka: Lucyna Róg
--
Grant z programu Opus + Lap jest czwartym, jaki prowadzi obecnie prof. Marcin Poręba. Razem ze swoim zespołem realizuje także badania w ramach programów Opus (1,3 mln zł) i Sonata (1,3 mln zł) Narodowego Centrum Nauki (wszystkie z pierwszego miejsca na liście rankingowej). Czwartym grantem, którym kieruje naukowiec, jest grant z programu „Wsparcie szpitali jednoimiennych w walce z rozprzestrzenianiem się zakażenia wirusem SARS-CoV-2 oraz w leczeniu COVID-19” Narodowego Centrum Badań i Rozwoju na kwotę ponad 1,8 mln zł, który realizuje we współpracy z Wojewódzkim Szpitalem Specjalistycznym we Wrocławiu.
























KOMENTARZE