Zastosowanie modeli translacyjnych wraz z analizą danych w zrozumieniu nowych aspektów procesów nowotworzenia
Jednym z badanych aspektów odpowiedzi immunologicznej jest zdolność cytotoksycznych komórek T oraz komórek NK do wywołania śmierci komórek nowotworowych (z ang. Immune Cell Killing Assay, ICK). Biologia molekularna dysponuje technikami pozwalającymi na badanie efektywności eliminowania komórek nowotworowych przez komórki układu odpornościowego. Są to m.in. metody cytometrii przepływowej czy testy biochemiczne. Chociaż są to cenne narzędzia, pokazują wyniki tylko w pojedynczych punktach czasowych, co ogranicza możliwość pełnego wglądu w zachowania biologiczne i zrozumienie procesów związanych ze zwalczaniem komórek nowotworowych. Dodatkowo, w miarę coraz szerszego stosowania modeli translacyjnych, rośnie potrzeba wprowadzenia testów ICK z wykorzystaniem sferoidów, a także adherentnych i nieadherentnych hodowli 2D. Celem niniejszego artykułu jest zwrócenie uwagi na rozwój technik pozwalających na obrazowanie przyżyciowe komórek w czasie rzeczywistym i ich wpływ na zrozumienie procesów nowotworzenia.
Ocena zdolności komórek odpornościowych do eliminacji komórek nowotworowych w badaniach nad nowotworem – kluczowe wyzwania
Jedną z kluczowych trudności podczas testu ICK jest brak możliwości określenia specyficznych dla komórek sygnałów cytotoksycznych w modelach hodowlanych. Przykładowo, podczas pomiaru uwalniania enzymów LDH i GAPDH, nie jest możliwe określenie, czy sygnał pochodzi ze śmierci komórek nowotworowych, czy odpornościowych. W celu określenia sygnałów specyficznych dla danych komórek można zastosować test uwalniania 51Cr, jednak test ten jest również obarczony pewnymi ograniczeniami. Wiele komórek nowotworowych nie do końca absorbuje znacznik chromu, co w konsekwencji ma wpływ na wyniki. [1,2] Drugim kluczowym aspektem jest ocena udziału komórek odpornościowych w indukowaniu śmierci komórek docelowych. Różne typy limfocytów T mogą odgrywać odrębne role w tym procesie. [3] Coraz częściej zwraca się również uwagę na cechy morfologiczne komórek, dlatego szczegółowe obrazowanie całego procesu, wraz z poznaniem danych kinetycznych i ilościowych, jest niezbędne.
Przyżyciowa analiza komórek w czasie rzeczywistym
Przyżyciowa analiza komórek bazująca na obrazowaniu w interwałach czasowych jest jedną z metod coraz częściej wprowadzaną do badań nad nowotworami. Platforma znajdująca się w inkubatorze pozwala na monitorowanie dynamicznych zdarzeń biologicznych i zmian behawioralnych w trakcie trwania całego doświadczenia, m.in podczas obserwacji, jak aktywowane komórki odpornościowe (zwane również komórkami efektorowymi) indukują śmierć komórek nowotworowych, zarówno w modelach 2D, jak i 3D. Dla ułatwienia obrazowania oraz oceny proliferacji komórki nowotworowe mogą zostać wybarwione barwnikiem jądrowym, podczas gdy ocenę śmierci komórek można zidentyfikować poprzez dodanie markera apoptozy komórkowej (Kaspazy 3/7 lub Aneksyny V).
W celu zilustrowania wykonano doświadczenie z użyciem komórek nowotworowych A549, wybarwionych odczynnikiem Incucyte®Nuclight Red oraz aktywowanych anty-CD-3, wraz z IL-2 komórek jednojądrzastych krwi obwodowej (z ang. peripheral blood mononuclear cell, PBMC), w stosunku 1:10. Do pomiaru apoptozy wykorzystano odczynnik Incucyte® Caspase 3/7. Tak przygotowane komórki umieszczono w aparacie ®Incucyte znajdującym się w inkubatorze. Zdjęcia wykonywano co dwie godziny przez okres czterech dni. Obrazy te następnie analizowano w celu oceny proliferacji komórek docelowych na podstawie liczby czerwonych obiektów (jąder) oraz ilościowego określenia śmierci komórek docelowych, bazując na liczbie zielonych obiektów (Fig. 1.). Wykazano, że aktywowane komórki układu odpornościowego skutecznie indukowały śmierć komórek nowotworowych, jednocześnie zmniejszając ich proliferację.
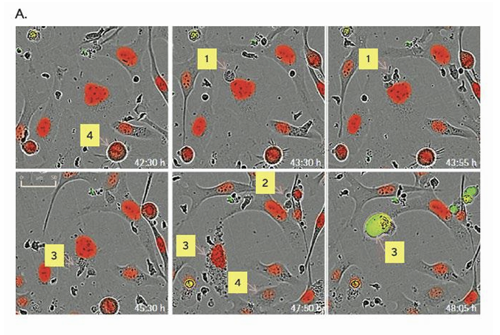
1. Kontakt fizyczny pomiędzy małym cytotoksycznym limfocytem T i większą wyznakowaną na czerwono komórką nowotworową
2. Komórki nowotworowe atakowane przez cytotoksyczny limfocyt T
3. Granulacja cytoplazmatyczna komórek nowotworowych i następujące po nim zabarwienie Incucyte® Caspase 3/7 (zielony), kondensacja jądrowa i śmierć komórki
4. Mitoza komórek nowotworowych
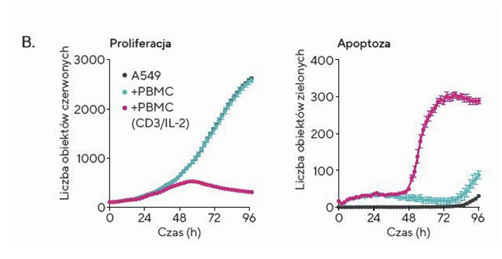
Fig. 1. Zastosowanie przyżyciowej analizy komórek w czasie rzeczywistym do oceny indukcji śmierci komórek nowotworowych przez komórki odpornościowe w prostym modelu hodowli 2D
A. Wizualizacja wzajemnego oddziaływania pomiędzy komórkami odpornościowymi i komórkami nowotworowymi
B. Przedstawienie ilościowe proliferacji i śmierci komórek nowotworowych w czasie rzeczywistym
Badanie przedstawione powyżej pokazuje podstawowe zastosowanie przyżyciowej analizy komórek w celu uzyskania jednoczesnych pomiarów proliferacji i apoptozy komórek nowotworowych oraz dostarczenia cennych danych jakościowych określających wzajemne oddziaływanie różnych typów komórek.
Uzyskiwanie dodatkowych informacji dzięki ulepszonej analizie danych
Kluczowym krokiem było opracowanie zaawansowanych algorytmów przetwarzania obrazu w celu zdefiniowania poszczególnych komórek. Ułatwieniem podczas analizy było wykorzystanie dodatkowego algorytmu bazującego na oprogramowaniu Incucyte® Cell-by-Cell. Umożliwia on identyfikację komórek bez potrzeby ich barwienia. Co więcej, oprogramowanie pozwala na klasyfikację komórek na podstawie ich cech morfologicznych (kształtu i rozmiaru).
Zastosowanie przyżyciowej analizy komórek do trójwymiarowych modeli sferoidów guza
Coraz więcej dowodów podkreśla znaczenie środowiska i architektury tkanki w modelowaniu złożonej relacji między komórkami odpornościowymi i nowotworowymi. W związku z tym wielu naukowców wykorzystuje modele 3D w celu uzyskania bardziej istotnych fizjologicznie danych podczas oceny immunoterapeutycznych środków przeciwnowotworowych in vitro. Rzeczywiście, dowody wskazują, że komórki nowotworowe hodowane w 3D mogą wykazywać podwyższoną odporność na cytotoksyczność, co lepiej odzwierciedla sytuację in vivo. [6]
Modele sferoidalne guza stanowią użyteczny sposób przedstawienia trójwymiarowego mikrośrodowiska nowotworu, ponieważ modelują ważne cechy, takie jak kontakt między komórkami i gradienty tlenu. [7,8] Jeden z powszechnie stosowanych typów modeli sferoidalnych w badaniach ICK wykorzystuje pojedyncze sferoidy, co stanowi przydatne narzędzie do badania w guzach litych. W tym celu przeprowadzono doświadczenie z wykorzystaniem pojedynczych sferoidów. Komórki A549, wyznakowane odczynnikiem jądrowym (Incucyte® Nuclight Red), wysiano na płytce 96-dołkowej i obserwowano tworzenie się sferoidów. Następnie dodano jednojądrzaste komórki krwi obwodowej (PBMC) w stosunku 1:2,5 i obserwowano ich wpływ na sferoidy w obecności oraz braku czynnika aktywującego (anty-CD3 oraz IL2). Zdjęcia były uzyskiwane w wybranych interwałach czasowych przez kilka dni. Otrzymane wyniki pokazują spadek intensywności fluorescencji sferoidów w obecności aktywowanych komórek układu odpornościowego, co odzwierciedla zwiększoną śmierć komórek nowotworowych (Fig 2).
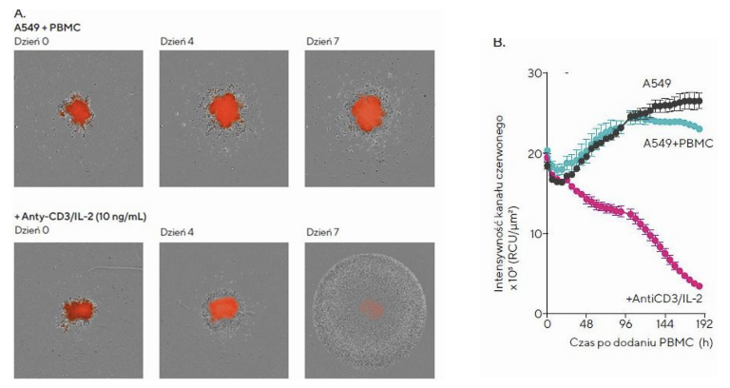
Fig. 2. Wpływ aktywowanych PBMC na proliferację sferoidów
A. Obrazy fazowe i fluorescencyjne porównują wpływ PBMC na proliferację sferoidów przy braku (górny wiersz) i obecności (dolny wiersz) aktywujących cytokin
B. Wykres utraty intensywności fluorescencji (oś Y) względem czasu (oś X). Dane przedstawiono jako średnią +/- SEM
Podsumowanie
Połączenie zaawansowanych modeli komórkowych z przyżyciową analizą komórek stanowi istotny postęp w badaniach nad chorobami nowotworowymi. Nieinwazyjne podejście pozwala na ciągłe gromadzenie istotnych danych, zwiększając wiedzę na temat mechanizmów choroby i efektów leczenia. Elastyczność i możliwości multipleksowania sprawiają, że metoda ta jest cennym narzędziem monitorowania ataku immunologicznego komórek nowotworowych ICK, oferując ogromny potencjał w zakresie postępów w badaniach immunoonkologicznych i odkrywaniu terapii.
Autorki:
PhD Aleksandra Wyciszkiewicz, Field Application Specialist CEE, Octet & Incucyte, Sartorius BioAnalytics
PhD Renata Gronczewska, Sales Manager BioAnalytics EEMA, mail: Renata.Gronczewska@Sartorius.com, tel.: +48 609 500 695
























KOMENTARZE