FLIM – mikroskopia obrazowania czasu życia fluorescencji
Mikroskopia obrazowania czasu życia fluorescencji (FLIM) jest techniką umożliwiającą badanie czasów życia fluorescencji w materiałach biologicznych. Zamiast klasycznego obrazowania fluorescencyjnego, które polega na analizie intensywności sygnału, FLIM mierzy czas, przez który cząsteczki fluorescencyjne emitują światło po wzbudzeniu. Dzięki tej metodzie możliwe jest uzyskanie informacji o środowisku molekularnym, takich jak: dynamika interakcji cząsteczek, pH czy lokalizacja w komórkach. Możliwe jest dzięki temu śledzenie procesów metabolicznych zachodzących w komórkach. FLIM pozwala na precyzyjne zróżnicowanie sygnałów pochodzących od różnych cząsteczek fluorescencyjnych, co sprawia, że jest to technika szczególnie użyteczna w badaniach biologicznych.
Spektroskopia Ramana
Spektroskopia Ramana z kolei to technika analityczna, która opiera się na nieelastycznym rozpraszaniu światła przez molekuły. Podczas tego procesu część światła jest rozpraszana w sposób inny niż zwykle (nieelastyczny ze zmianą energii), co dostarcza cennych informacji o wibracjach i drganiach cząsteczek. Powstałe widmo Ramana stanowi „molekularny odcisk palca” próbki, dostarczając wysoce szczegółowych informacji o składzie chemicznym i strukturze molekularnej. Pojedyncze widmo Ramana z próbki biologicznej dostarcza informacji na temat:
• konkretnych biomarkerów i biocząsteczek,
• obecności i struktury białek,
• zmian w kwasach nukleinowych i metabolitach,
• zmian nasycenia lipidów i zmian składu.
W kontekście biomedycznym ma to ogromne znaczenie, gdyż umożliwia analizę składu chemicznego tkanek i komórek, identyfikując specyficzne grupy chemiczne oraz ich zmiany w procesach patologicznych. Co więcej, możliwość obrazowania składu chemicznego poszczególnych struktur komórkowych, tkanek (Rys. 1.) czy nawet całych organów bez wprowadzania dodatkowych barwników czy znaczników chemicznych, które mogą wpływać bezpośrednio na procesy komórkowe, czyni ze spektroskopii Ramana unikalne narzędzie do badania zmian patologicznych na poziomie komórkowym i tkankowym, dzięki czemu istnieje możliwość szybszej diagnozy przypadku pacjenta i podejmowania decyzji dotyczących leczenia. Dzięki wysokiej rozdzielczości czasowej i przestrzennej ta technika jest wykorzystywana do oceny struktury białek, lipidów, węglowodanów czy kwasów nukleinowych, co czyni ją niezastąpioną w diagnostyce chorób nowotworowych i neurodegeneracyjnych.
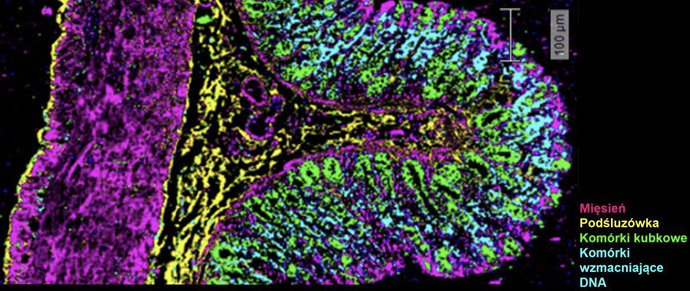
Rys. 1. Obraz Ramana analizy głównych składowych (PCA) krypty jelita grubego szczura
Połączenie FLIM i spektroskopii Ramana
FLIM, jak już wspomniano, jest bardzo przydatny w naukach przyrodniczych do analizy próbek biologicznych, w tym mikroorganizmów, komórek i tkanek. Jest kompatybilny ze spektroskopią Ramana, ponieważ może wykorzystywać autofluorescencję próbki do generowania sygnału. Ani FLIM, ani obrazowanie Ramana nie wymagają zewnętrznego znakowania, które może zmienić próbki. Obie techniki są nieinwazyjne i nieniszczące. FLIM jest szybki w porównaniu ze spektroskopią Ramana, więc stanowi skuteczną metodę szybkiej oceny różnic w próbkach. Raman może następnie dostarczyć wysoce specyficznych informacji chemicznych. W tabeli poniżej przedstawiono unikalne cechy obu technik, które sprawiają, że ich połączenie stanowi idealne narządzie badawcze w naukach przyrodniczych, farmaceutycznych i medycynie.
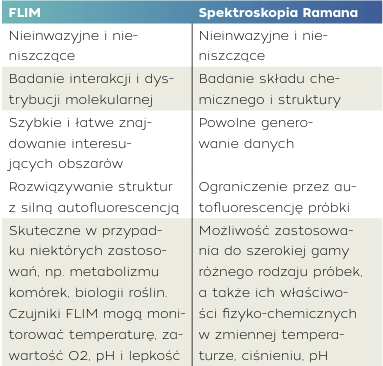
Tab. 1. Porównanie techniki FLIM i spektroskopii Ramana
Komórki to złożone, dynamiczne systemy. Związek między strukturą chemiczną a interakcjami między cząsteczkami ma fundamentalne znaczenie dla utrzymania zdrowia komórek. Zrozumienie tego związku pozwala nam odróżnić zdrowe komórki od chorych, a także identyfikować i monitorować stany chorobowe czy badać in vitro metabolizm i skuteczność nowych leków na hodowlach komórkowych. Spektroskopia Ramana i FLIM to uzupełniające się techniki analizy komórek.
Spektroskopia Ramana dostarcza danych chemicznych, które mówią nam o strukturze i składzie próbki, natomiast FLIM informuje o interakcjach molekularnych, aby dać przegląd mikrośrodowiska próbki i aktywności metabolicznej. Wykonaliśmy korelacyjną mikroskopię FLIM-Raman przy użyciu mikroskopu ramanowskiego Renishaw inVia™ wyposażonego w moduł obrazowania FLIM do badania komórek ssaków i drożdży. Dane ramanowskie zebrano przy użyciu wzbudzenia laserowego 532 nm, a obraz FLIM – impulsowego lasera 405 nm z częstotliwością repetycji 20 MHz. Oba lasery wykorzystywały tę samą ścieżkę optyczną, umożliwiając zintegrowaną korelację obu technik. Stolik skanujący xyz był podłączony do zewnętrznego modułu wyzwalającego, komunikującego się bezpośrednio z oprogramowaniem SPC firmy Becker & Hickl. Umożliwiło to zarejestrowanie przestrzennego pochodzenia każdego fotonu i dokładną korelację obrazów Ramana i FLIM. Zarówno oprogramowanie WiRE™ firmy Renishaw, jak i oprogramowanie SPC firmy Becker & Hickl zostały zintegrowane, umożliwiając zdefiniowanie pojedynczego obszaru próbki w oprogramowaniu WiRE zarówno dla pomiarów Ramana, jak i FLIM. Obrazowanie FLIM można wykonać z prędkością do 10 tys. punktów na sekundę.
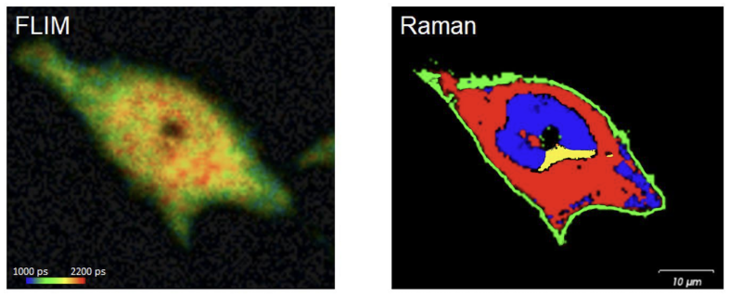
Rys 2. Korelacja analizy FLIM-Raman nieoznakowanej komórki HeLa. Obraz Ramana z analizy Empty Modelling™ pokazujący składniki odpowiadające różnym strukturom komórkowym. Obraz FLIM pokazujący średnie czasy życia fluorescencji
Z uzyskanych wyników widzimy, że obraz Ramana dostarcza szczegółowych i specyficznych informacji chemicznych, które umożliwiają wyraźne zdefiniowanie regionów komórkowych. Zidentyfikowano komponenty odpowiadające: jądru (kolor niebieski), cytoplazmie (kolor czerwony), błonie (kolor zielony) i dodatkowej strukturze okołojądrowej, która prawdopodobnie odpowiada organelli komórkowych, np. siateczce śródplazmatycznej i/lub aparatowi Golgiego (kolor żółty). Natomiast obraz FLIM pokazuje dłuższe średnie czasy życia fluorescencji w centrum komórki (na zewnątrz jądra) i krótsze czasy życia na zewnątrz komórki. Jest to zgodne z posiadaniem większej proporcji związanego białka (np. NADH) w centrum komórki, co wskazuje na wyższą aktywność metaboliczną. Organelle komórkowe są skoncentrowane centralnie w komórkach, w sąsiedztwie jądra, więc prawdopodobnie wyjaśnia to, dlaczego aktywność metaboliczna jest wyższa w tych obszarach. Korelacyjne informacje dostarczone przez analizę FLIM-Raman wskazują, że organelle komórkowe są aktywne metabolicznie, co sugeruje dobre ogólne zdrowie komórek i w kontekście ogólnej chemii komórkowej, i podskładników. Powyższy przykład pokazuje, że obrazowanie FLIM umożliwia badania in situ procesów metabolicznych, takich jak glikoliza, stres oksydacyjny lub aktywność mitochondriów, przy użyciu autofluorescencji koenzymów NADH i FAD, które są związane z wewnętrznymi białkami jako bezpośredni pomiar metabolizmu, np. guza nowotworowego, ocenę stadiów śmierci komórek i skuteczności leków. Połączenie nieinwazyjnych i wrażliwych na cząsteczki technik in situ oraz zaawansowanego modelowania umożliwia powtórzenie fizjologii i metabolizmu guza in vitro i ułatwia przesiewowe badania nad indywidualnymi dla pacjenta opcjami leczenia farmakologicznego.
Wiemy, że pomimo znacznych udoskonaleń w diagnostyce i opcjach terapeutycznych, leczenie raka nadal cierpi na późne wykrywanie i specyficzną dla pacjenta oporność na wiele leków, co powoduje ograniczoną skuteczność systemowych terapii lekowych. Stąd obecne postępy firmy Renishaw w spektroskopii Ramana i mikroskopii obrazowania czasu życia fluorescencji oraz ich nieinwazyjnym zastosowaniu w identyfikacji nowotworów in vitro i in vivo, monitorowaniu wczesnego stadium, przesiewie leków i analizie metabolicznej są niewątpliwie przyszłością dla klinicystów i mogą uzupełnić obecne metody diagnostyczne. Uzyskując dostęp do sygnatur spektralnych specyficznych dla tkanek i komórek, mikrospektroskopia Ramana stała się narzędziem diagnostycznym do identyfikacji zmian przednowotworowych, stadiów raka lub złośliwości komórek. Pomiary Ramana in vivo zostały umożliwione przez ostatnie postępy technologiczne w endoskopii Ramana i układy wzmacniające sygnał, takie jak koherentna antystokesowska spektroskopia Ramana lub powierzchniowo wzmocniona spektroskopia Ramana.
Połączenie FLIM ze spektroskopią Ramana stanowi przełom w metodach analizy biomedycznej, oferując unikalną możliwość uzyskania zarówno informacji o dynamice fluorescencji, jak i składzie chemicznym badanych próbek. Takie zintegrowane podejście pozwala na bardziej wszechstronną ocenę procesów zachodzących w organizmach żywych, umożliwiając jednoczesne śledzenie interakcji molekularnych i zmian w strukturze chemicznej tkanek. Zastosowanie tych technologii w diagnostyce medycznej może pozwolić na wczesne wykrywanie chorób, takich jak nowotwory, choroby neurodegeneracyjne (np. Alzheimer czy Parkinson), a także monitorowanie procesów zapalnych i infekcji. Przykładem jest wykorzystanie połączonych technik w badaniach nowotworów, gdzie FLIM dostarcza informacji o mikrośrodowisku guza, a spektroskopia Ramana pozwala na analizę zmian chemicznych związanych z procesami rakowymi. Takie podejście może pozwolić na wykrywanie subtelnych zmian biochemicznych w komórkach nowotworowych, które mogą stanowić wczesne wskaźniki rozwoju choroby.
Choć połączenie FLIM i spektroskopii Ramana ma ogromny potencjał, jego zastosowanie w praktyce wiąże się z pewnymi wyzwaniami. Jednym z nich jest konieczność precyzyjnego skalibrowania obu technik, aby uzyskane dane były spójne i mogły być bezbłędnie interpretowane. Udało się to osiągnąć dzięki systemowi inVia Qontor Raman-FLIM od Renishaw i Becker & Hickl, dzięki czemu pojedyncze fotony o widma Raman są zbierane z tego samego miejsca na próbce, w tym samym czasie. Dzięki specjalistycznemu oprogramowaniu WiRE do analizy wyników techniki te stają się bardziej dostępne dla klinicystów, a analiza danych nie stanowi już tak dużej bariery. Bez wątpienia rozwój nowych technologii obrazowania i coraz lepsze możliwości analizy danych stwarzają realne perspektywy dla wprowadzenia tych metod do codziennej diagnostyki biomedycznej.
Podsumowanie
Połączenie technik FLIM i spektroskopii Ramana otwiera nowe horyzonty w analizie biomedycznej, umożliwiając szczegółową ocenę zarówno dynamiki molekularnej, jak i składu chemicznego tkanek i komórek. Tego rodzaju zintegrowane podejście jest obiecujące w kontekście wczesnej diagnostyki chorób, szczególnie w zakresie onkologii i neurologii. Choć napotykają one pewne wyzwania technologiczne, jak np. brak znormalizowanych protokołów, zwłaszcza w przypadku obrazowania FLIM, które jest wysoce wrażliwe na fizjologiczne środowisko komórek, ich przyszłość w medycynie wydaje się bardzo obiecująca, a dalszy rozwój tych metod może przyczynić się do znacznego postępu w precyzyjnej medycynie.
Autorka: Agnieszka Sozańska, kierownik sprzedaży produktów spektroskopowych w Renishaw
--
Więcej informacji na temat zastosowań Ramana prod. Renishaw oraz technik połączonych, takich jak mikroskopie FLIM, AFM czy SEM, można znaleźć na stronie Renishaw. Dzięki bogatemu doświadczeniu w czołówce technologii przyrządów ramanowskich od ponad 30 lat, wspieranemu przez globalną strukturę, firma Renishaw jest partnerem, na którym można polegać teraz i w przyszłości. Zapraszamy do współpracy!



























KOMENTARZE