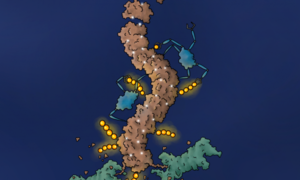
Związek chemiczny indukuje polimeryzację białka BLC6. Autor ilustracji: Jonas Koeppel
BCL6 to jedno z niezliczonych białek ludzkiego organizmu. Jest kluczowe w różnicowaniu komórek krwi i regulacji pracy wielu innych białek. Zbyt duża ilość BCL6 może spowodować rozpoczęcie procesu nowotworzenia i rozwój nowotworów układu limfatycznego, m.in. chłoniaków. Badania na modelach komórkowych i zwierzęcych chłoniaka pokazały, że inaktywacja właśnie tego białka prowadzi do zaniku choroby.
Przez wiele lat próbowano więc opracować lekarstwo, które obniżyłoby poziom „złego" BCL6, ale testowane związki nie były wystarczająco efektywne. – Problem polega na tym, że obecnie duża część leków nowotworowych, to tzw. inhibitory, które blokują konkretne funkcje białek. A niestety tylko część chorobotwórczych białek reaguje na ich działanie. BCL6 się do nich nie zalicza – tłumaczy PAP Mikołaj Słabicki z Broad Institute of MIT and Harvard w Cambridge, Dana-Farber Cancer Institute w Bostonie i niemieckiego Centrum Badań nad Rakiem w Heidelbergu.
W laboratorium, w którym pracuje, poszukiwane są nowe metody pozwalające na unieszkodliwienie właśnie tych chorobotwórczych białek, których blokowanie klasycznymi inhibitorami jest nieefektywne lub wręcz niemożliwe. Takie leki już istnieją, działają np. na zasadzie „klejów molekularnych", czyli degraderów łączących źle działające białko z innym białkiem (zwanym ligazą ubikwityny), które je unieszkodliwia. Do nich zalicza się np. Lenalidomid, stosowany m.in. w leczeniu szpiczaka mnogiego, jak również niedawno opisany związek CR8.
Trzy lata temu firma farmaceutyczna Boehringer Ingelheim, szukając substancji, która zablokowałaby działanie białka BCL6, przeanalizowała prawie 2 mln związków chemicznych znajdujących się w jej zasobach. Jednym ze zidentyfikowanych związków był niezwykle efektywny degrader białka BCL6. Ta niewielka molekuła inicjuje proces niszczenia BCL6, powodując specyficzną śmierć komórek nowotworowych. Nie był jednak znany dokładny mechanizm tego procesu, przez co trudno było taki związek udoskonalić do wykorzystania w potencjalnych terapiach. Wyjaśnienia poszukali więc badacze pod kierownictwem prof. Benjamina Eberta i prof. Erica Fischera z Dana-Farber Cancer Institute. Zagadkowy dotąd mechanizm udało im się wyjaśnić, a jego opis opublikowało prestiżowe „Nature" (DOI: 10.1038/s41586-020-2925-1). Głównymi autorami pracy są: Mikołaj Słabicki, Hojong Yoon, Jonas Koeppel.
Aby prześledzić, co dzieje się z białkiem BCL6 po podaniu związku-degradera, naukowcy oznaczyli je białkiem fluorescencyjnym umożliwiającym jego obserwację w komórkach. Dzięki temu zauważyli, że degrader powoduje powstawanie agregatów (skupienia komórek) BLC6, które po kilkudziesięciu minutach znikają. – Podczas badania tychże agregatów okazało się, że białko BCL6 pod wpływem degradera ulega najpierw procesowi polimeryzacji, czyli jego kolejne molekuły sklejają się w długą, polimerową nić – wyjaśnia Radosław Nowak, współautor badań z Dana-Farber Cancer Institute w Bostonie. Badacze zidentyfikowali też ostatni element układanki: odkryli ligazę ubikwityny (o nazwie SIAH1), która efektywnie niszczy spolimeryzowane białko BCL6.
– Nigdy nie szukano lekarstw, które powodowałyby polimeryzację źle działających białek. Teraz już wiemy, że coś takiego jest możliwe – opisuje Słabicki. – Mamy nadzieję, że tę samą metodę można by wykorzystać do pozbycia się innych białek, których deregulacja może prowadzić do procesów nowotworzenia – podkreśla. Animację wyjaśniającą odkryty mechanizm można obejrzeć poniżej:
Autorka: Ewelina Krajczyńska (PAP)























KOMENTARZE